喜讯频传!司美格鲁肽注射液在外周动脉疾病(PAD)患者中的临床证据获得权威认可——近日,该药(诺和泰®)中文说明书获批更新,正式纳入针对症状性PAD合并2型糖尿病(T2DM)患者的STRIDE研究数据[1];与此同时,刚刚发布的2026年美国糖尿病协会(ADA)《糖尿病医学诊疗标准》也首次纳入这项研究[2]。STRIDE研究证实,每周一次皮下注射司美格鲁肽1.0 mg,可显著改善症状性PAD合并T2DM患者的功能结局、症状和生活质量。基于其已被广泛证实的多重心肾代谢获益,此次说明书与指南的双重认可,为这类患者提供了更为明确和优化的治疗选择。

PAD是一种累及下肢、发病率很高的动脉粥样硬化性血管疾病,全球患病人数已超2.3亿,是T2DM患者最常见的早期心血管表现之一[3]。在T2DM人群中,PAD与更严重的功能障碍、更高的肢体不良事件及截肢风险相关[4]。
值得注意的是,PAD所致功能损害常在早期即已存在,却因症状隐匿而被忽视[5]。患者非特异性症状与日常活动量逐渐减少,往往掩盖其行走能力与身体功能的显著下降,而这代表着疾病进展[5]。因此,早期诊断对于改善功能状态、提升生活质量及延缓疾病发展至关重要[6]。ADA建议对以下糖尿病患者进行无症状PAD筛查:年龄≥65岁、病程≥10年,或已出现微血管病变、糖尿病相关终末器官损害或足部并发症者[7]。尽管有上述建议,PAD的检测仍未能得到充分应用,原因有多方面,部分在于针对早期患者尚缺乏有效的治疗方法以改善其功能和症状。
目前,监督性运动疗法虽有证据支持,却因可及性受限、认知度不高及长期接受度较低而难以广泛推广;即便接受干预,许多患者仍持续存在活动能力受限[5]。药物治疗方面,美国指南唯一推荐的西洛他唑自1999年获批以来,因副作用明显、心衰风险黑框警告及缺乏额外获益而使用受限;另一获批用于缓解症状的己酮可可碱则被证实对功能无显著改善,未获指南推荐;其他疗法获益有限或不稳定,且均未能降低其他心血管结局风险或在缓解症状之外提供额外心血管代谢获益[5]。因此,针对PAD功能损伤的药物治疗,仍存在显著的临床未满足需求。
二、成功破局:STRIDE研究为司美格鲁肽用于PAD合并T2DM治疗提供坚实依据
STRIDE研究是一项3b期、双盲、随机、安慰剂对照试验,于2020年10月1日~2024年7月12日从北美、亚洲和欧洲20个国家112个门诊研究中心开展。研究入选T2DM合并间歇性跛行(Fontaine IIa期)的PAD患者,踝肱指数(ABI)≤0.90或趾肱指数(TBI)≤0.70。所有患者在标准治疗基础上,以1:1比例随机分配至每周一次皮下注射司美格鲁肽1.0 mg组或安慰剂组,治疗为期52周。主要终点为第52周时恒定负载跑步机测试中最大步行距离(MWD)较基线的变化;确证性次要终点包括第57周时MWD较基线的变化、第52周时血管生活质量问卷-6(VascuQoL-6)评分较基线的变化,以及第52周时无痛步行距离(PFWD)较基线的变化(图1)[3]。
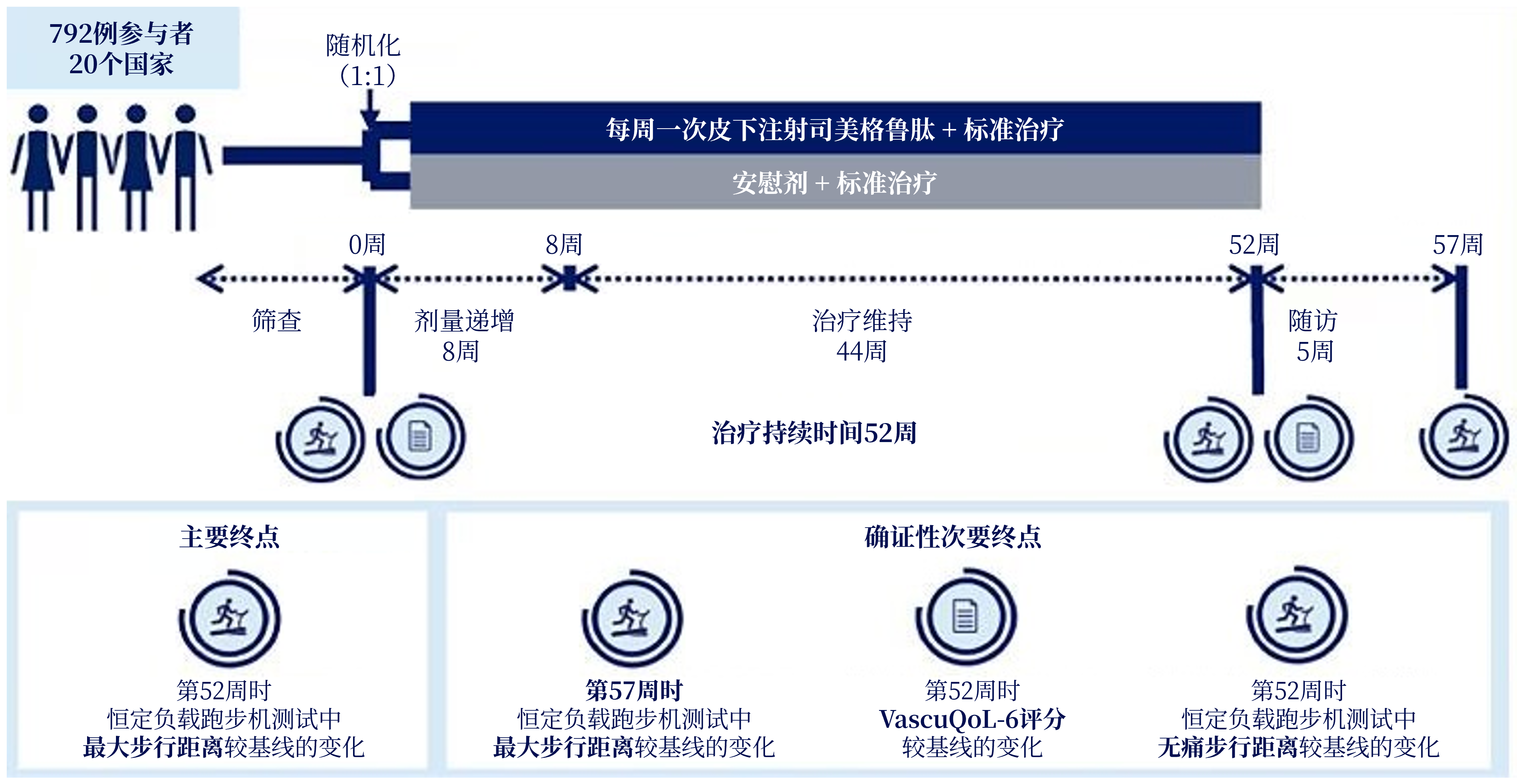
图1. STRIDE研究设计
研究共筛选1363例患者,最终792例完成随机分组(司美格鲁肽组n=396,安慰剂组n=396),其中中国入组56例(7.1%)。受试者中位年龄68岁,男性占75%,中位糖尿病病程12年,平均糖化血红蛋白(HbA1c)7.3%,平均体重指数(BMI)29.6 kg/m2。基线中位MWD为185米[5]。
研究结果:司美格鲁肽展现多维获益,显著改善功能、症状与生活质量
主要终点:
第52周时,与安慰剂组相比,司美格鲁肽组MWD较基线显著改善达13%[估计治疗比(ETR)1.13,95%CI:1.06~1.21,P=0.0004],中位增加26.4米,平均增加39.9米[5](图1)。
确证性次要终点:
第57周时,与安慰剂组相比,司美格鲁肽组MWD改善仍更显著(ETR 1.08,95%CI:1.00~1.16,P=0.038);第52周时,司美格鲁肽组VascuQoL-6评分改善显著更优(P=0.011),PFWD显著改善达11%(P=0.0046)[5](图2)。
支持性次要终点:
第52周时,与安慰剂组相比,司美格鲁肽组的SF-36量表身体功能领域评分改善更显著(ETR 1.25,95%CI:0.26~2.24,P=0.013),ABI显著升高,体重显著下降(平均变化:-5.2 kg vs. -1.2 kg,ETR -4.1,95%CI:-4.8~-3.4,P<0.0001),BMI变化与MWD改善存在较弱相关性[5]。
探索性事后分析:
司美格鲁肽组报告挽救性治疗或全因死亡的复合终点比例为4%,显著低于安慰剂组的8%(HR 0.46,95%CI:0.24~0.85),提示疾病进展风险降低54%[5,8];类似趋势亦见于包含主要肢体不良事件的扩展复合终点[5]。
亚组分析:
无论患者年龄、性别、地域、HbA1c、BMI、糖尿病病程或合并糖尿病用药如何,司美格鲁肽对MWD或PFWD的改善作用均保持一致(P交互作用均>0.05)(图3)[5,8]。
安全性:
两组治疗相关严重不良事件发生率均较低(司美格鲁肽组1%,安慰剂组2%),最常见为胃肠道事件,无治疗相关死亡事件[5]。
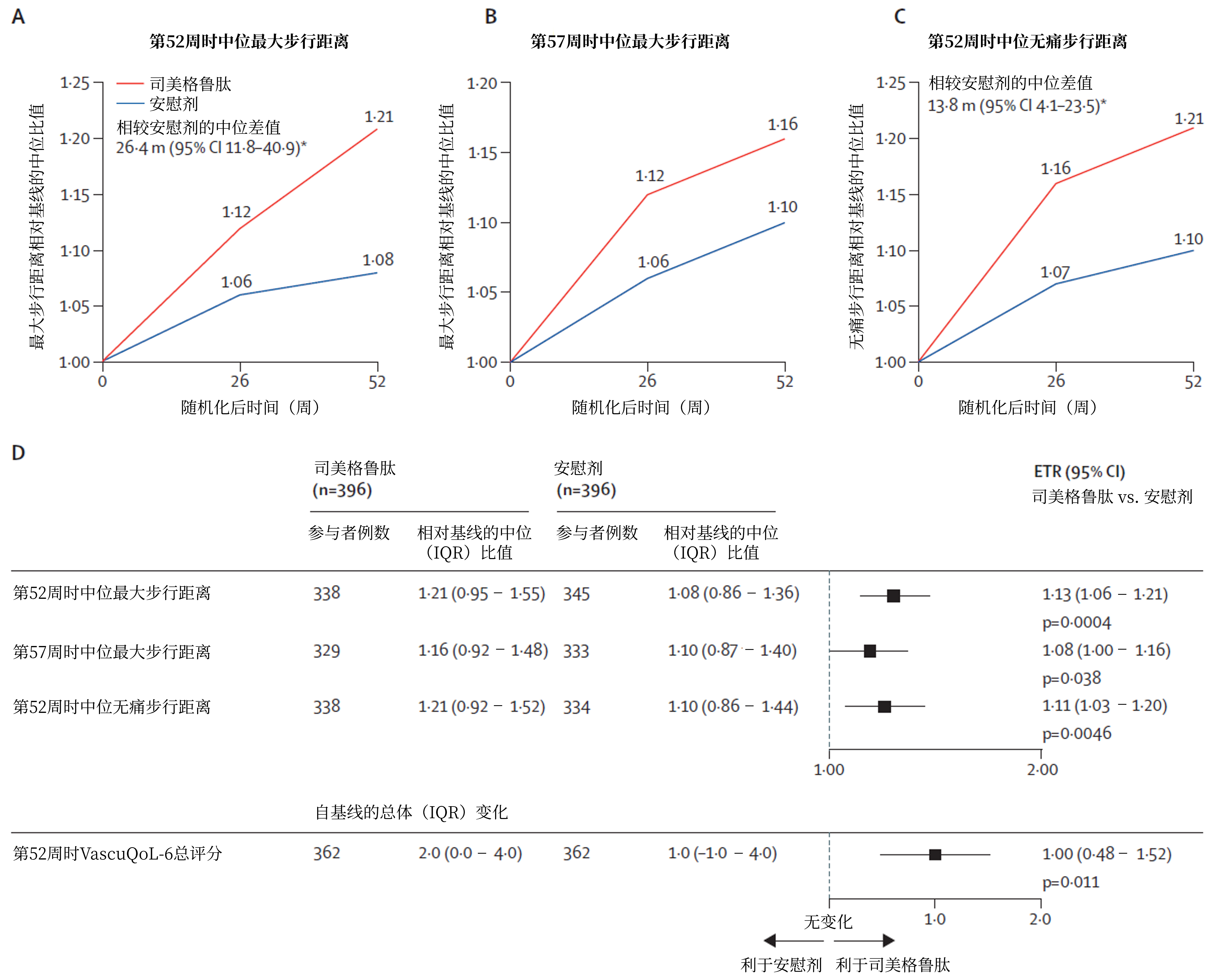
图2. STRIDE研究的主要终点和确证性次要终点
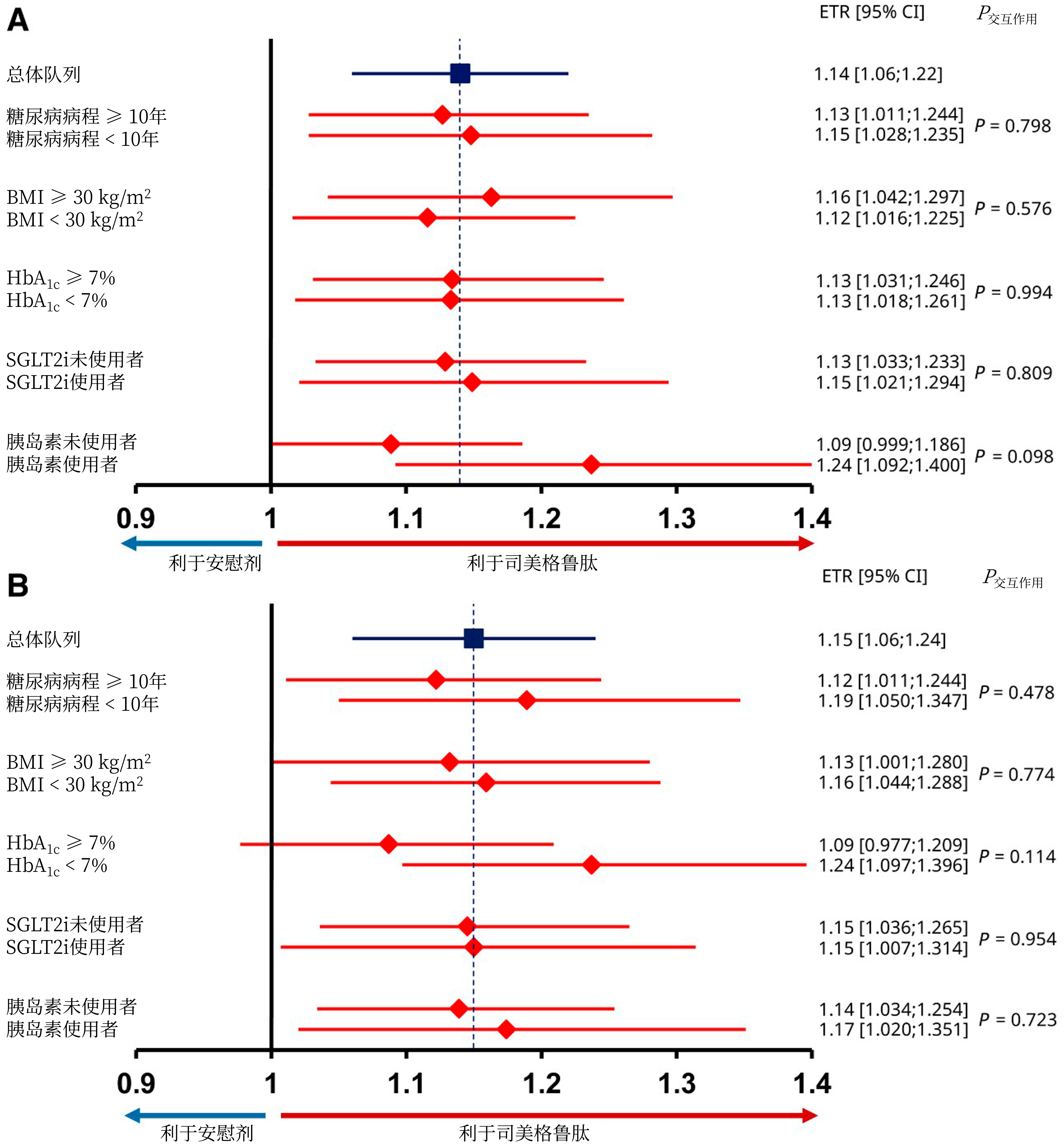
图3. STRIDE研究中根据T2DM特征分层的MWD(A)和PFWD(B)改善情况
研究解读:超越减重,血管保护与抗炎机制驱动功能改善
尽管司美格鲁肽的治疗获益机制尚未完全阐明,现有研究提示其可改善炎症状态与血管功能,并带来广泛的心血管代谢获益[9-12]。STRIDE研究中,BMI变化与功能改善之间关联较弱,提示体重减轻对功能能力提升的贡献有限;而ABI的增加,结合既往观察到的微血管改善作用,支持司美格鲁肽具有直接的血管益处,可能由其抗炎作用介导[13,14]。
此外,司美格鲁肽的部分临床获益可能源于其对其他广泛共同疾病通路和结局的影响,包括体重减轻、心血管代谢调节、肾脏保护、主要心血管不良事件风险降低以及心衰相关获益[9-11]。这些综合效应使其在作用机制和临床价值上显著区别于传统药物如西洛他唑,也优于其他虽具心血管获益但未能改善PAD症状的心血管代谢药物[15-17]。
值得注意的是,无论患者的糖尿病病程、基线BMI或HbA1c水平如何,亦无论是否联合使用SGLT2i或胰岛素,司美格鲁肽均能在第52周时显著改善步行距离[4],表明其功能获益具有高度普适性,适用于不同代谢特征的PAD合并T2DM患者。结合其已被证实的心肾保护作用[10,11],司美格鲁肽有望成为PAD合并T2DM患者实现功能改善和心肾风险防控双重目标的基础治疗选择。
三、里程碑意义:STRIDE研究同步写入中文说明书与2026ADA指南,加速临床转化
STRIDE研究数据被同步纳入司美格鲁肽中文说明书更新[1]与2026ADA指南[2],标志着该循证成果向临床实践转化取得两项关键突破,具有深远意义。一方面,中文说明书的更新意味着中国药品监管部门正式认可司美格鲁肽用于PAD合并T2DM治疗,为临床医生提供了明确、权威的用药依据;另一方面,作为全球糖尿病管理的权威指导文件,ADA指南的采纳进一步确立了司美格鲁肽在全球范围内作为PAD合并T2DM治疗新选择的地位。这一双重认可不仅肯定了司美格鲁肽在改善PAD合并T2DM患者步行功能方面的独特价值,更凸显其超越降糖的综合获益,包括血管保护、心肾风险降低及生活质量提升等。由此,PAD合并T2DM临床治疗策略得以从单一症状管理迈向整合性、多目标的综合干预新模式。
四、总结与展望:开启PAD合并T2DM综合管理新纪元
STRIDE研究以高质量循证证据证实,每周一次皮下注射司美格鲁肽1.0 mg可显著改善症状性PAD合并T2DM患者的步行功能、症状及生活质量,且安全性良好。此次STRIDE研究数据同步写入中文说明书与2026ADA指南,不仅是对司美格鲁肽临床价值的权威肯定,更标志着PAD合并T2DM管理正式迈入功能改善+心肾代谢保护并重的新时代。未来,随着研究证据的不断积累与治疗路径的持续优化,司美格鲁肽有望在更广泛PAD患者群体中发挥重要作用,切实提升患者长期预后与生活质量。
参考文献
1. 司美格鲁肽注射液(诺和泰®)说明书. 修改日期: 2025年12月11日.
2. American Diabetes Association Professional Practice Committee for Diabetes. Diabetes Care. 2026; 49 (Suppl_1): S261-S276.
3. Bonaca MP, et al. Eur Heart J Cardiovasc Pharmacother. 2025; 10(8): 728-737.
4. Rasouli N, et al. Diabetes Care. 2025; 48(9): 1529-1535.
5. Bonaca MP, et al. Lancet. 2025; 405(10489): 1580-1593.
6. Behan SA, et al. J Am Coll Cardiol. 2022; 79(17): 1781-1783.
7. American Diabetes Association Professional Practice Committee. Diabetes Care. 2025; 48(Suppl_1): S207-S238.
8. Marc P. Bonaca. The Effect of Once-weekly Subcutaneous Semaglutideon Functional Capacity in People with Type 2 Diabetes and Peripheral Artery Disease: Primary Results from The Phase 3b, Randomized, Placebo-controlled, Double Blind Stride Trial. 102-09. Presented at Late-Breaking Clinical Trials, March 29, ACC.25.
9. Kosiborod MN, et al. N Engl J Med. 2023; 389(12): 1069-1084.
10. Lincoff AM, et al. N Engl J Med. 2023; 389(24): 2221-2232.
11. Perkovic V, et al. N Engl J Med. 2024; 391(2): 109-121.
12. Mosenzon O, et al. Cardiovasc Diabetol. 2022; 21(1): 172.
13. Caruso P, et al. JAMA Netw Open. 2024; 7(3): e241545.
14. Russell KS, et al. Vasc Med. 2019; 24(5): 414-421.
15. Beebe HG, et al. Arch Intern Med. 1999; 159(17): 2041-2050.
16. Dawson DL, et al. Circulation. 1998; 98(7): 678-686.
17. Bonaca MP, et al. JAMA. 2022; 328(13): 1302-1303.
2 comments









 京公网安备 11010502033361号
京公网安备 11010502033361号
发布留言