2025年12月已过半,年终将至。每到此时,年终盘点便成为一项令人颇费思量的任务:若仅做简单罗列,恐难以满足读者期待;欲寻求突破与创新,又常感思路困顿。经反复斟酌,认为不妨回顾本年度糖尿病领域的若干学术争议,或能为同行提供一些启发与思考。

该争议的起源是《中国糖尿病防治指南(2024版)》[1]在治疗路径上做出的重大调整:强调以心肾并发症为主导,制定初始降糖治疗方案,即2型糖尿病(T2DM)患者如果合并动脉粥样硬化性心血管疾病(ASCVD)或其高风险因素、慢性肾脏病(CKD),应首选有心血管和肾脏获益的胰高糖素样肽-1受体激动剂(GLP-1RA)或钠-葡萄糖共转运蛋白2抑制剂(SGLT2i);如果合并心力衰竭,应首选有心力衰竭获益的SGLT2i。在新路径中,二甲双胍对于大多数T2DM患者的起始治疗不再作为首选,而是被列为二线或次选药物,其理由是缺乏改善心肾结局的过硬证据。
然而,国际糖尿病联盟(IDF)发布的《2025全球2型糖尿病临床实践指南》[2]仍然推荐二甲双胍作为全球范围内T2DM起始治疗的首选口服降糖药物,是优化与基础诊疗的共同基石。该指南指出,对于合并高心肾风险的患者,SGLT2i与GLP-1RA的使用应基于心肾风险,但这并非是对二甲双胍的治疗替代,而是在其基础上的强强联合。尤其在基础诊疗路径中,考虑药物可及性与成本限制,二甲双胍联合SGLT2i是更优选的治疗策略。
近日,《国家基层糖尿病防治管理指南(2025)》[3]正式发布。在降糖治疗路径中,该指南继续明确二甲双胍作为T2DM治疗的一线基石用药地位,同时强调如无禁忌证且能耐受药物者,二甲双胍应贯穿药物治疗的全程。
基于当前不同指南推荐之间的差异,作者在此强烈呼吁,我们有必要对这一决定T2DM治疗方向的关键问题展开深入探讨。建议立足事实、依据证据,从有效性、安全性、方便性及经济性等方面进行全方位评估,以期早日形成更为合理与统一的临床共识。
2、GLP-1类药物会增加甲状腺癌和其他肿瘤的风险吗?
该争议的起源为动物实验提示的潜在风险。在啮齿类动物实验中,GLP-1RA可显著增加甲状腺C细胞肿瘤的发生风险,这与GLP-1受体在动物甲状腺C细胞中高表达及其对细胞增殖的促进作用有关。然而,动物实验中采用的药物暴露剂量通常远高于人类临床用量,且不同物种间甲状腺组织中GLP-1受体的表达水平和敏感性存在差异。因此,动物实验结果不能直接外推至人类。
目前学术界普遍认为,临床研究并未发现GLP-1RA与人类甲状腺癌风险之间存在显著关联。多项大规模临床研究,包括国际多中心队列研究及回顾性分析等显示,GLP-1RA在人类应用中并未显著增加甲状腺癌的发生风险。例如,Thyroid发表的一项研究[4]纳入250万例T2DM患者,对比GLP-1RA与二肽基肽酶4抑制剂(DPP-4i)使用者,发现GLP-1RA组的甲状腺癌风险未见显著升高(HR 0.81,95%CI:0.59~1.12)。Diabetes Care上的另一项研究[5]通过分析多国医疗数据库,对比GLP-1RA与其他二线降糖药物,同样未发现GLP-1RA增加甲状腺肿瘤(包括恶性肿瘤)的风险。尽管部分研究观察到用药初期甲状腺癌诊断率略有上升,但经分析认为,这主要与用药后甲状腺筛查频率增加有关,而非药物本身致癌。
特殊人群应严格遵循GLP-1RA药品说明书的指导规范治疗行为。例如,有甲状腺髓样癌(MTC)个人史或家族史,或多发性内分泌腺瘤综合征2型(MEN2)的患者禁用GLP-1RA,因为这些人群的甲状腺C细胞对GLP-1的敏感性可能更高,存在理论上的潜在风险。
综上所述,目前临床证据支持GLP-1RA在普通人群中使用是安全的,尚未发现其明显增加甲状腺癌风险的确凿证据。
此外,今年发表于JAMA Oncology的一项研究[6]探讨了GLP-1RA与癌症风险之间的关联。该研究利用人工智能(AI)机器学习方法,分析2014~2024年美国南部三州86 632例超重/肥胖成人数据,旨在精准识别高风险与潜在获益人群。结果显示,使用GLP-1RA与总体癌症风险降低相关,其中子宫内膜癌风险下降31%、卵巢癌风险下降24%、脑膜瘤风险下降8%;但肾癌风险可能增加,尤其在65岁以下或超重人群中,但此结果尚待进一步验证。基于上述发现,超重男性可能需要优先评估肾癌风险,肥胖女性使用GLP-1RA的获益可能显著高于潜在风险。
3、GLP-1RA对眼部健康有多大影响?
GLP-1RA与眼病的关系较为复杂,既有潜在保护作用,也可能存在一定的风险。具体表现如下:
潜在保护作用减缓糖尿病视网膜病变(DR)进展:GLP-1RA可通过改善血糖控制、减轻氧化应激和炎症反应,延缓DR进展。长期稳定使用GLP-1RA有助于减少视网膜血管损伤,降低玻璃体出血、新生血管性青光眼等严重并发症的发生风险。
降低年龄相关性黄斑变性(AMD)风险:研究发现,GLP-1RA可能通过调节视网膜代谢、抑制异常血管生成,降低非渗出性AMD的发生风险。其抗炎和抗氧化作用有助于保护视网膜色素上皮细胞,延缓黄斑区病变的发展。
对青光眼的潜在保护作用:GLP-1RA可能通过改善眼部血液循环、调节眼压,对青光眼起到一定的保护作用。部分研究提示,其有助于维持视神经的正常血供,减少视神经损伤风险。
潜在风险
非动脉炎性前部缺血性视神经病变(NAION):部分研究提示GLP-1RA可能与NAION发生相关。快速纠正高血糖可能导致视神经肿胀和缺血,尤其在血糖波动较大的患者中风险可能增加。但目前尚未明确因果关系,仍需进一步研究验证。
新生血管性年龄相关性黄斑变性(nAMD)风险增加:有研究发现,长期使用GLP-1RA(尤其是超过30个月)可能增加糖尿病患者发生nAMD的风险。这可能与GLP-1受体激活后促进血管内皮生长因子(VEGF)表达有关,具体机制尚需深入探索。2025年6月,多伦多大学眼科和视觉科学系Rajeev H. Muni博士团队发表在JAMA Ophthalmology的研究[7]发现,在老年糖尿病人群中,系统性使用GLP-1RA与nAMD发病风险显著相关,约为未使用者的两倍。
DR早期恶化:在血糖快速下降的初期,部分患者可能出现DR暂时加重,称为“早期恶化”现象。这可能是由于长期高血糖导致视网膜血管脆弱,血糖突然改善引起血流动力学改变所致,但通常不影响长期预后。
总体而言,GLP-1RA在眼病防治中呈现双向作用。对于糖尿病患者,合理使用GLP-1RA并配合定期眼部检查,可在控制血糖的同时降低严重眼病的发生风险。临床医生在处方药物时需综合评估患者的眼部健康状况,必要时加强监测和干预。
4、GLP-1RA会成为延缓衰老、延长健康寿命的“长寿药”吗?
理想的抗衰老方法应具备以下特点:①药理学方法易于应用;②安全性好,治疗窗口宽;③能够广泛应对衰老过程中影响不同器官系统的各种疾病;④可与其他治疗靶点产生协同作用。
2025年11月19日,香港中文大学研究团队在Cell Metabolism发表的一项研究[8]发现,GLP-1RA能够广泛对抗多种与衰老相关的改变,具体表现为以下几个方面:
全身性多组学抗衰老效应:GLP-1RA可通过激活GLP-1受体,诱导全身多组织的基因表达、表观遗传和代谢状态向年轻化逆转。在衰老小鼠模型中,GLP-1RA治疗显著改善肌肉力量、运动协调性等生理功能,并逆转下丘脑、大脑皮层、心脏、骨骼肌、脂肪等器官中与衰老相关的基因表达及DNA甲基化模式,表明其抗衰老作用具有全身性和多维度特点。
下丘脑是核心调控枢纽:下丘脑中的GLP-1受体是GLP-1RA发挥抗衰老作用的关键靶点。实验表明,敲低下丘脑GLP-1受体后,GLP-1RA的全身性抗衰老效应明显减弱甚至消失,提示下丘脑通过GLP-1受体调控全身衰老进程,是抗衰老的“指挥中心”。
与经典抗衰老药物机制相似:GLP-1RA的抗衰老分子效应与雷帕霉素(mTOR抑制剂)高度相似。两者在转录组、表观遗传组和代谢组层面均呈现相似的衰老逆转模式,提示它们可能作用于共同的抗衰老分子通路,这为抗衰老药物研发提供了新思路。
潜在临床应用前景:GLP-1RA已广泛应用于糖尿病和肥胖治疗,其抗衰老潜力为拓展临床应用提供了新方向。未来或可通过优化GLP-1RA的给药方式或开发新型制剂,进一步探索其在延缓衰老及相关疾病(如神经退行性疾病、心血管疾病)中的治疗价值。
需要指出的是,目前关于GLP-1RA抗衰老作用的研究主要基于动物实验,其在人类中的长期安全性和有效性仍需更多临床研究加以验证。
5、GLP-1RA:需要从单靶与双靶向三靶发展吗?
靶向GIP/GLP-1/胰高糖素的“三重激动剂”Retatrutide(瑞他鲁肽)在最新3期临床试验TRIUMPH-4中取得突破性结果[9]。该研究针对伴有膝骨关节炎的肥胖患者,经过约16个月(68周)的治疗,高剂量组(12 mg)实现平均28.7%的体重减轻,创下目前临床减重疗效最高纪录,效果堪比代谢手术。
除主要终点外,该研究在所有次要终点上也均达到统计学显著性,包括减重幅度≥25%、≥30%或≥35%的患者比例——这在医学研究中尚属首次设立如此高标准的减重目标。同时,Retatrutide显著改善多项心血管风险生物标志物,如非高密度脂蛋白胆固醇、甘油三酯及高敏C反应蛋白水平;在12 mg剂量组中还观察到患者血压显著下降。
在一项针对肥胖合并膝骨关节炎患者的研究中,Retatrutide在减重的同时,也显著降低了患者的疼痛评分(基于WOMAC量表)。
安全性方面,高剂量组约20%的患者报告感觉异常(如皮肤灼烧感或疼痛),多数为轻度,但发生率值得关注。此外,高剂量组因不良事件导致的停药率为18.2%,低剂量组(9 mg)为12.2%,安慰剂组为4%。值得注意的是,部分患者停药原因为“认为体重下降过多”。总体而言,Retatrutide作为三重受体激动剂展现出强劲的减重与代谢改善潜力,但其全面评价仍需等待将于2026年公布的另外7项3期试验数据,包括针对单纯肥胖患者的TRIUMPH-1,以及针对肥胖合并T2DM患者的TRIUMPH-2,届时也将提供关于4 mg维持剂量的相关数据。
6、胰淀素类似物会成为新一代减重药物领导者吗?
长久以来相对低调的靶点——Amylin(胰淀素),正快速成为全球药物研发的新焦点。作为被寄予厚望、有望开启“减重药物下半场”的关键角色,胰淀素已跃升至相关研究领域的核心。
胰淀素是一种由37个氨基酸组成的饱腹感多肽激素,存储于胰腺β细胞中。当营养物质进入小肠时,胰淀素与胰岛素共同由胰腺β细胞释放入血,两者水平呈现同步升降。该激素能够促进及时产生饱腹感,避免摄食过量,从而降低能量摄入;同时还可促进能量代谢、减少脂肪组织重量,在体重与血糖调控中发挥多重作用。
与GLP-1类药物相比,胰淀素类似物在减重过程中能显著提升肌肉保留率,减少肌肉流失,实现“减脂少减肌”的效果,并具有更好的胃肠道耐受性。目前,多个胰淀素类似物及联合疗法已展现出显著的临床潜力,值得重点关注:
MET-233i:一种超长效月制剂胰淀素类似物,在36天内即可实现高达8.4%的减重幅度[10]。
CagriSema:由GLP-1RA司美格鲁肽与胰淀素类似物cagrilintide组成的联合制剂,其在3期临床研究REDEFINE 1中减重幅度达22.7%[11],凸显了胰淀素作为协同靶点的巨大价值。
Amycretin:一种同时作用于GLP-1受体和胰淀素的单分子长效药物,1b/2a期临床研究显示,每周一次60 mg皮下注射治疗36周后,患者体重平均降低达24.3%[12],表现出强大的减重潜力。
Eloralintide:一种选择性胰淀素受体激动剂周制剂,今年公布的2期临床研究数据显示,其最高剂量组在治疗48周时实现平均减重20.1%[13]。
综合其独特的作用机制、显著的临床数据表现及日益增长的资本关注,胰淀素正从一个边缘靶点迅速崛起,成为减重治疗领域新的战略高地。
7、FGF21靶点会成为代谢性疾病的治疗明星吗?
2025年下半年,成纤维细胞生长因子21(FGF21)成为全球代谢性疾病药物研发中最受关注的靶点之一。FGF21是一种由肝脏分泌的激素样因子,通过激活FGFR1-β-Klotho受体复合物,发挥调控全身糖脂代谢、增加胰岛素敏感性和能量消耗的核心生理作用。
临床研究数据显示,FGF21类似物在降低肝脏脂肪含量、改善纤维化程度、减轻体重以及调节血脂谱方面效果显著,有望为代谢相关脂肪性肝炎(MASH)的治疗带来突破性进展。以下候选分子目前进展较为突出:
Efruxifermin:一种Fc-FGF21融合蛋白,采用每周一次皮下注射给药,耐受性良好。该药在两项2b期MASH临床研究HARMONY[14]与SYMMETRY[15]中均显示出积极结果。为期96周的研究数据表明,其在肝硬化与纤维化的改善及逆转方面取得了前所未有的效果。
Pegozafermin:一种经聚乙二醇化修饰的FGF21类似物。针对29项MASH临床试验的荟萃分析显示,该药在纤维化改善和MASH缓解方面展现出最佳的整体组织学反应[16]。
Efimosfermin alfa:同样为Fc融合蛋白,凭借其超长的半衰期,有望实现每月仅给药一次。这对于需要长期用药的慢性病患者而言,可显著提升用药依从性。研究显示,治疗24周后,45%的MASH患者肝纤维程度获得显著改善[16]。
总之,FGF21靶向药物不仅有望在MASH治疗领域占据重要地位,未来还可能通过与GLP-1等机制联合或融合,推动代谢性疾病的治疗策略从“单点突破”向“系统调控”转变。
8、GLP-1RA和SGLT2i可以在1型糖尿病治疗中应用吗?
基于现有循证医学证据,GLP-1RA在1型糖尿病(T1DM)患者中的潜在获益主要包括:保存β细胞功能、降低血糖波动、减少每日胰岛素用量、体重管理以及心血管与代谢获益[17]。其主要不良反应以胃肠道反应为主,如恶心、呕吐、腹泻等,多数患者可耐受。此外,GLP-1RA可能增加酮症风险,尤其在胰岛素剂量调整不当或患者处于应激状态时。因此,用药期间需密切监测血糖和酮体水平,以预防酮症酸中毒的发生[18]。
目前关于SGLT2i在T1DM患者中的临床研究涉及达格列净、恩格列净、卡格列净等多种药物。综合分析表明,SGLT2i可改善T1DM患者的血糖控制,减少胰岛素用量,但同时也存在酮症酸中毒和泌尿生殖道感染等风险升高[19]。2019年相关国际共识[20]指出,在T1DM患者中使用SGLT2i时需严格遵循以下原则:谨慎减少胰岛素剂量,起始治疗前酮体水平应低于0.6 mmol/L,治疗期间规范监测酮体水平,若出现恶心、呕吐、腹痛等症状应立即停药,直至酮体恢复正常方可考虑重新用药。该共识还对SGLT2i相关酮症酸中毒风险进行了分级,以帮助临床识别高危人群并谨慎用药。
若考虑联合使用这两类药物,需各用最小剂量:若以血糖控制为主要目的,SGLT2i的选择理由更多;若以体重管理为主要目的,GLP-1RA更具优势;若以减少胰岛素用量为主要目的,两者效果相当;若以改善血糖波动为主要目的,SGLT2i的选择理由更多;若以心血管保护为主要目的,SGLT2i的选择理由也相对较多[21-23]。不良反应方面,GLP-1RA的胃肠道反应明显更多,而SGLT2i在低血糖、乏力及泌尿生殖道感染等方面的报告相对较多[21-23]。小剂量联合可能增强疗效,减轻单药治疗相关不良反应。
总之,目前关于这两类药物在T1DM患者中应用的疗效与安全性证据仍有限,尚不足以作出一般性推荐。但在某些特定临床情况(如胰岛素用量过大或合并超重/肥胖等)下,可考虑个体化应用。处方这些药物之前,首先应优化胰岛素治疗方案,并与患者充分沟通,签署知情同意书。
9、LDL-C水平降到多少,才能稳住斑块不破裂?
斑块破裂最重要的危险因素是血脂异常[24],其中低密度脂蛋白胆固醇(LDL-C)水平与斑块成分及斑块体积显著相关[25,26]。既往研究[27]表明,高LDL-C组的斑块破裂发生率高于低LDL-C组,同时脂质富集斑块和巨噬细胞的检出率也更高;与通过他汀治疗达到低LDL-C水平的患者相比,天然低LDL-C水平患者的斑块破裂风险更低。这些发现提示,终生累积的LDL-C水平可能是影响斑块破裂的关键因素,因此为有效预防斑块破裂,有必要建议更早启动血脂管理。
《2019欧洲心脏病学会(ESC)/欧洲动脉粥样硬化学会(EAS)血脂异常管理指南:2025重点更新》[28]对LDL-C目标值进行了更严格的风险分层(图1),以更好地指导临床实践并降低心血管事件风险。具体分层标准如下:
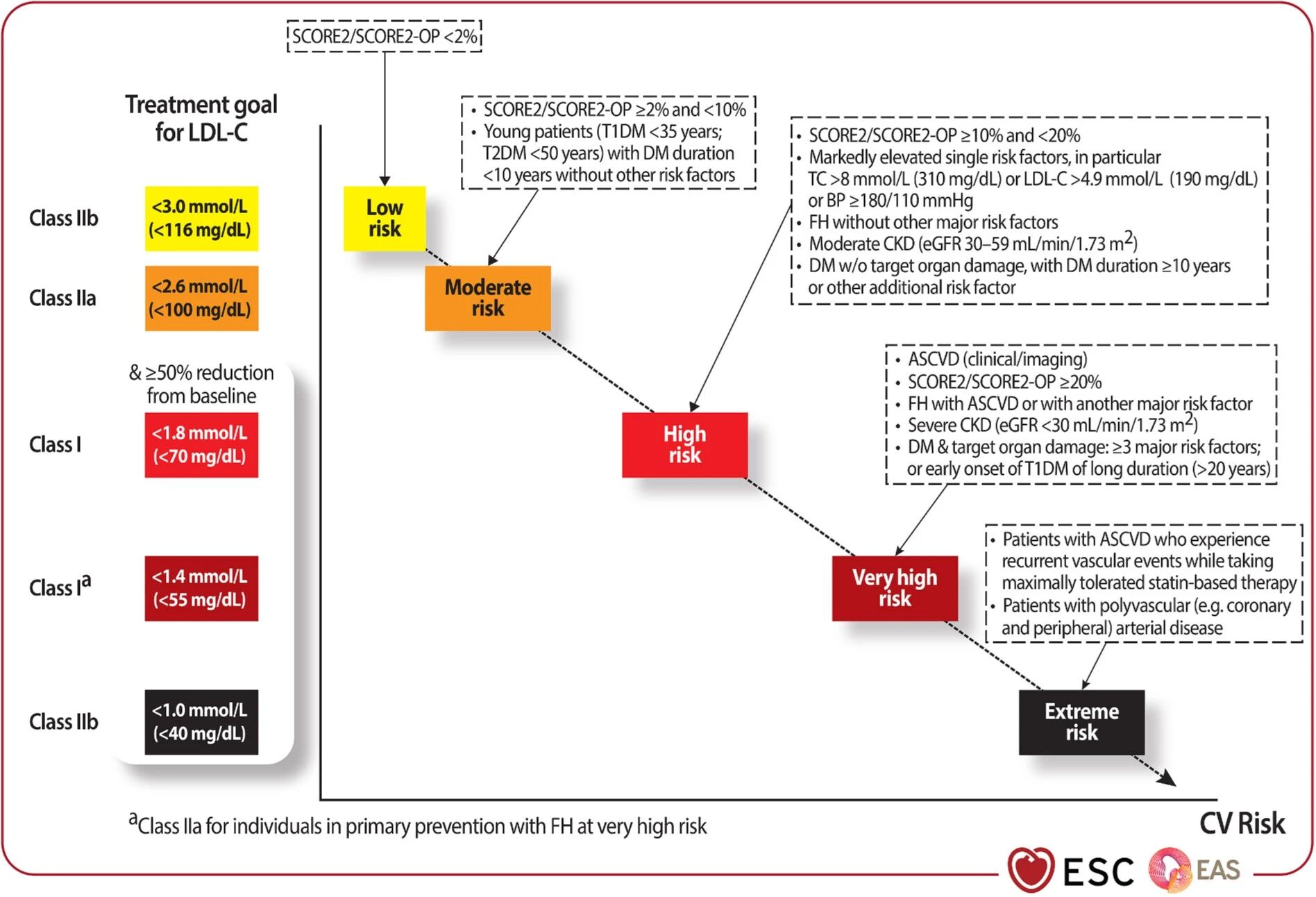
图1. 不同总体心血管风险分层的LDL-C治疗目标
超高危患者:LDL-C目标值<1.0 mmol/L(<40 mg/dl)
涵盖人群包括:①在服用最大耐受剂量他汀类药物治疗期间仍发生复发性血管事件的ASCVD患者;②患有多血管(例如冠状动脉和外周动脉)疾病的患者。
此为本次指南更新的突破性调整,强调对此类患者进行更严格的血脂管理,以最大程度降低再发事件风险。将LDL-C降至1.0 mmol/L以下是否过低?今年11月发表于Circulation的一项研究[29]对5291例既往缺血性卒中患者分析发现,LDL-C降至<40 mg/dl的患者主要终点事件风险显著降低31%,所有卒中风险降低27%,缺血性卒中风险降低25%,且未观察到出血性卒中风险增加。该结果缓解了以往对胆固醇降得过低可能增加脑出血风险的担忧。
极高危患者:LDL-C目标值<1.4 mmol/L(<55 mg/dl)
包括:①经临床或影像学证实的ASCVD;②SCORE2/SCORE2-OP评分>20%;③家族性高胆固醇血症(FH)合并ASCVD,或合并另1个主要危险因素;④重度CKD(eGFR<30 ml/min/1.73m2);⑤糖尿病合并靶器官损害,或伴有≥3个主要危险因素,或为早发T1DM且病程>20年。
高危患者:LDL-C目标值<1.8 mmol/L(<70 mg/dl)
涵盖:①SCORE2/SCORE2-OP评分>5%且<10%;②单个危险因素显著升高,特别是总胆固醇>8 mmol/L,或LDL-C>4.9 mmol/L(190 mg/dL),或血压>180/110 mmHg;③不伴其他主要危险因素的FH;④中度CKD(eGFR 30~59 ml/min/1.73m2);⑤糖尿病合并/不合并靶器官损害,且病程>10年,或伴有其他额外危险因素。
中危患者:LDL-C目标值<2.6 mmol/L(<100 mg/dl)
包括:①SCORE2/SCORE2-OP评分>2%且<5%;②年轻糖尿病患者(T1DM年龄<35岁;T2DM年龄<50岁)且病程<10年,不伴有其他危险因素。
低危患者:LDL-C目标值<3.0 mmol/L(<116 mg/dl)
指SCORE2/SCORE2-OP评分<2%的人群。
此外,对于高危至超高危患者,治疗目标不仅包括达到上述LDL-C目标值,还要求将LDL-C水平较基线降低≥50%。
10、当SGLT2i遇上尿路感染:继续使用,还是停用?
2025年10月发表在Eur Heart J的一项研究[30]为此提供了新的证据。该研究基于中国香港地区全人群医疗系统数据库,纳入2015~2022年61 606例使用SGLT2i的T2DM患者,旨在分析发生尿路感染对心肾结局的影响,并比较感染后继续用药与停药的长期结局。
随访期间,共有3921例(6.36%)患者发生尿路感染,其中约8.4%为重度感染。研究显示,发生尿路感染的患者其心血管及肾脏风险均显著升高,约为未感染者的2.5~3倍。这提示,尿路感染并非仅为局部感染事件,而可能是引发系统性炎症反应的重要诱因。在发生尿路感染的患者中,32.3%选择停用SGLT2i。然而,停药并未降低尿路感染的复发风险,反而与更高的心肾事件及死亡率相关。因此,因担忧感染风险而停用SGLT2i可能并非合理选择。
该研究提示,在临床实践中需采取审慎处理策略,而非一概停药。对于轻中度尿路感染,绝大多数患者经过抗生素治疗后可安全继续用药;仅在出现严重感染如如败血症或肾盂肾炎时,才考虑暂时停药,并在感染控制后重新评估是否恢复使用。此外,医生应加强患者教育,包括注意个人卫生、适量饮水、避免长时间憋尿、识别尿路感染早期症状,并定期复查肾功能及尿常规。对患者而言,长期使用SGLT2i的心肾获益远高于其暂时性感染风险。
2025年已接近尾声,新征程的序幕即将开启。愿在新的一年里,我们坚持以研究和证据解决更多争议,以不懈努力和专业耕耘,共同谱写糖尿病防治事业更加辉煌的明天!
参考文献
1. 中华医学会糖尿病学分会. 中华糖尿病杂志. 2025; 17(1): 16-139.
2. International Diabetes Federation. IDF Global Clinical Practice Recommendations for Managing Type 2 Diabetes – 2025. https://idf.org/t2d-cpr-2025
3. 基本公共卫生服务项目基层糖尿病防治管理办公室, 中华医学会糖尿病学分会. 中华内科杂志. 2025; 64(12): 1169-1186.
4. Baxter SM, et al. Thyroid. 2025; 35(1): 69-78.
5. Morales DR, et al. Diabetes Care. 2025; 48(8): 1386-1394.
6. Dai H, et al. JAMA Oncol. 2025; 11(10): 1186-1193.
7. Shor R, et al. JAMA Ophthalmol. 2025; 143(7): 587-594.
8. Huang J, et al. Cell Metab. 2025; 37(12): 2362-2380.e8.
9.https://investor.lilly.com/news-releases/news-release-details/lillys-triple-agonist-retatrutide-delivered-weight-loss-average
10.https://www.clinicaltrialvanguard.com/news/metsera-announces-positive-phase-1-data-of-amylin-candidate/
11. Garvey WT, et al. N Engl J Med. 2025; 393(7): 635-647.
12. Dahl K, et al. Lancet. 2025; 406(10499): 149-162.
13. Billings LK, et al. Lancet. 2025; 406(10520): 2631-2643.
14. Noureddin M, et al. Lancet. 2025; 406(10504): 719-730.
15. Noureddin M, et al. N Engl J Med. 2025; 392(24): 2413-2424.
16. Souza M, Al-Sharif L, et al. Hepatology. 2025; 82(6): 1523-1533.
17. Noureddin M, et al. ONCE-MONTHLY EFIMOSFERMIN ALFA (BOS-580) IN METABOLIC DYSFUNCTION-ASSOCIATED STEATOHEPATITIS WITH F2/F3 FIBROSIS: RESULTS FROM A 24 WEEK, RANDOMIZED, DOUBLE-BLIND, PLACEBO-CONTROLLED, PHASE 2 TRIAL. Abstract presented at Digestive Disease Week 2025 in San Diego, CA, from May 3 - May 6, 2025.
18. Delrue C, et al. Int J Mol Sci. 2024; 25(17): 9351.
19. Ma Y, et al. Front Biosci (Landmark Ed). 2023; 28(5): 98.
20. Danne T, et al. Diabetes Care. 2019; 42(6): 1147-1154.
21. Edwards K, et al. Ther Adv Endocrinol Metab. 2023; 14: 20420188231180987.
22. Edwards K, et al. J Clin Endocrinol Metab. 2023; 108(4): 920-930.
23. Anson M, et al. Diabetologia. 2023; 66(10): 1869-1881.
24. Burke AP, et al. N Engl J Med. 1997; 336(18): 1276-1282.
25. Cheng VY, et al. Am J Cardiol. 2010; 105(6): 761-766.
26. Hartmann M, et al. Am J Cardiol. 2006; 98(11): 1419-1423.
27. Kurihara O, et al. Am J Cardiol. 2020; 134: 48-54.
28. Mach F, et al. Eur Heart J. 2025; 46(42): 4359-4378.
29. Monguillon V, et al. Circulation. 2025 Nov 3. doi: 10.1161/CIRCULATIONAHA.125.077549.
30. Wu MZ, et al. Eur Heart J. 2025 Oct 17: ehaf788.










 京公网安备 11010502033361号
京公网安备 11010502033361号
发布留言