编者按
当前对糖尿病机制的认知正经历根本性转变,核心已超越β细胞功能障碍,转向β、α、δ细胞构成的精密调控网络失衡。2025年9月15日,第61届EASD年会在维也纳开幕,瑞典于默奥大学U. Ahlgren教授、加拿大阿尔伯塔大学P.E. MacDonald教授和中国首都医学科学创新中心任会霞教授,在专题会“胰岛内分泌细胞生物学新进展对1型和2型糖尿病的启示”上,多角度探讨胰岛细胞在健康和糖尿病状态下的前沿发现,对深入理解糖尿病发病机制、开发新治疗策略意义重大。
三维定量解析:胰腺β细胞的分布
在教科书中,正常胰岛的细胞组成大致按以下比例分布:分泌胰岛素的β细胞约占60%,是胰岛的主体;分泌胰高血糖素的α细胞约占30%;其余约10%为分泌胰多肽的PP细胞、分泌生长抑素的δ细胞以及分泌胃饥饿素的ε细胞等。然而,传统组织学方法难以在完整器官尺度上精确量化这些细胞群体的三维空间分布。U. Ahlgren教授课题组[1]提出了一种可在完整人体器官内重建抗体标记细胞分布、同时保留其原始三维结构的简易方法(图1)。利用该方法,课题组能够精确获取目标细胞的多种定量参数:包括体积、表面积、平均三维直径、大小分类及球形度等形态学数据;通过荧光强度值(如总和、均值、最大值、最小值及标准差)衡量其分子表达特性;同时在空间维度上,可获得细胞的三维坐标、与其他对象的距离,并可通过聚类分析评估其分布模式。
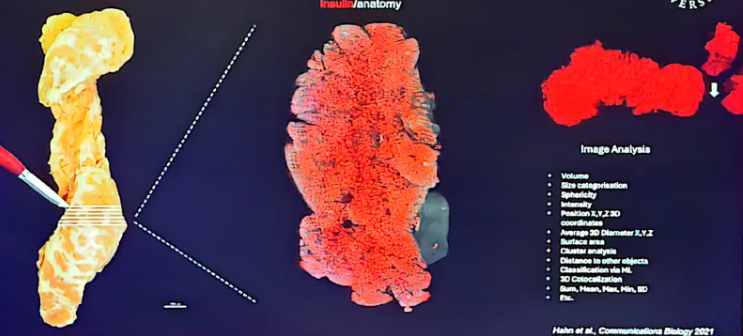
图1. 三维结构方法和多种定量参数
通过对整个腺体体积内的每个INS+结构进行三维体积分析[2],课题组获得了约2.26×106个胰岛的精确数据(以一名28岁、BMI 23.7 kg/m2、HbA1c 35 mmol/mol的男性供者胰腺为例,其INS+胰岛总体积达1.17 cm3)。分析不仅揭示了β细胞在胰腺头尾长轴上总体均匀的空间分布特征(平均密度约2.8%),更对每一个胰岛的体积、表面积、平均直径、形状(球形度)、三维坐标及与邻近胰岛的距离等参数进行了全面量化。另外,在25~49岁范围内的5个非糖尿病供者胰腺中,观察到了相似的β细胞质量分布模式,这表明该评估方法具有可靠性,并为在三维水平上精确量化β细胞质量与分布提供了重要依据(图2)。
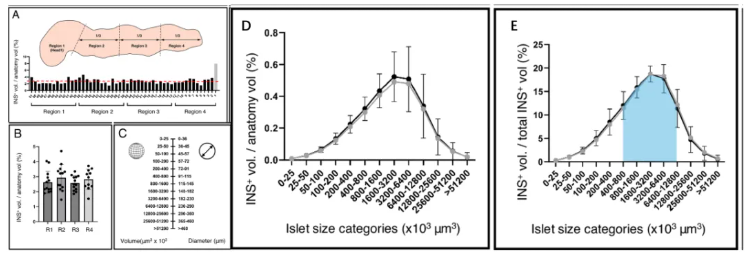
图2. 人类全胰腺β细胞三维分布模式的量化与统计分析
另一项研究[3]通过三维成像技术揭示了LO-T1D(成人隐匿性自身免疫糖尿病)患者与正常人(ND)胰腺中β细胞分布的根本差异。该研究通过光学投影断层扫描和光片荧光显微镜对LO-T1D与正常对照(ND)的胰腺组织进行三维成像与量化分析,旨在详细评估LO-T1D患者残留β细胞质量的空间分布。结果显示,两者之间存在根本性差异(图3)。在ND胰腺中,高达92%的β细胞集中于胰岛结构内,而以簇状或散在形式存在的胰岛外β细胞占比极低(共约8%);相反,在LO-T1D胰腺中,残留的β细胞分布发生了彻底逆转,仅有15%与残存的胰岛结构相关,而高达85%以胰岛外形式存在,其中63%为散在单个细胞,22%为小型细胞簇。这种分布模式的剧变导致,与ND组相比,LO-T1D患者胰岛内B细胞密度减少到原来的1/1452,胰岛外B细胞密度减少到原来的1/23。可见,LO-T1D的病理特征并非单纯的β细胞总量减少,更关键的是其空间分布模式的根本性重构,即残留的β细胞主体由胰岛内转移至胰岛外。
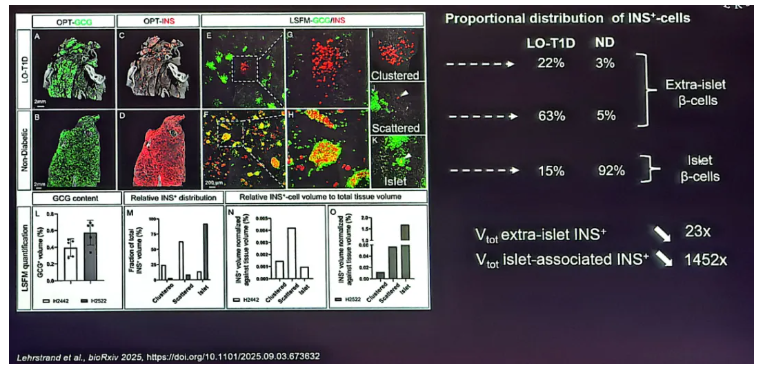
图3. LO-T1D中残留的β细胞质量主要构成-胰岛外β细胞
深入解析胰岛在细胞与空间上的异质性,是连接其微观结构与宏观功能的核心环节,对糖尿病领域的基础研究与临床转化具有决定性意义。
T1DM和T2DM中的α细胞异质性
胰腺α细胞的功能紊乱是糖尿病病理机制中的重要环节,其胰高血糖素分泌失调现象已被确认,然而,导致该功能障碍的内在分子机制及其是否在所有α细胞中普遍发生,仍是尚未完全阐明的关键科学问题。MacDonald教授团队[4]整合电生理、转录组学与计算方法对人和小鼠α细胞进行系统研究,发现谱系与身份识别因子在α细胞中呈现异质性表达。在2型糖尿病(T2DM)中,高表达这些因子的α细胞亚群更易失去成熟度与电生理表型(图4)。免疫染色证实ARX、MAFB及胰高血糖素在蛋白水平上调;独立单细胞RNA测序数据[5]进一步显示,T2DM患者ARX高表达α细胞特异性上调幼年α细胞特征谱[6]、组织发育基因及β细胞样基因谱,热图分析亦揭示该幼年基因集在ARX高表达组中显著富集。
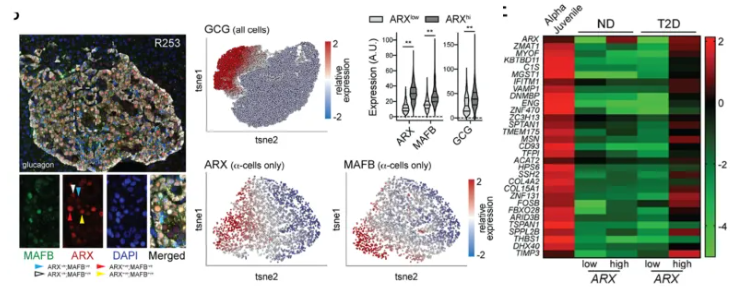
图4. α细胞成熟状态异常参与2型糖尿病中的α细胞功能障碍
另一方面,在1型糖尿病(T1DM)中,α细胞表现出功能异常与电生理特性改变(发表准备中)。具体而言,T1DM的α细胞呈现过度兴奋性,其特征为KATP通道功能紊乱,并对特定刺激产生异常增强的反应。这种α细胞功能障碍具有异质性,并与免疫信号通路上调、mTORC1通路激活及溶酶体调控紊乱相关联。值得注意的是,与α细胞功能障碍相关的转录本在T1DM遗传风险变异中显著富集,尤其在免疫和蛋白酶体通路中。此外,关键α细胞转录因子核输入受阻,与其特有的“电生理身份”受损密切相关(图5)。
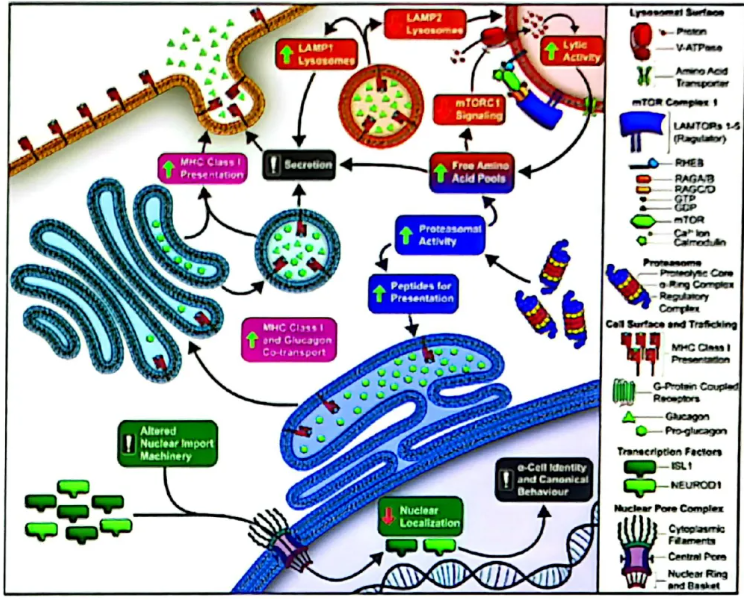
图5. 1型糖尿病中的α细胞分子机制
除上述已发表/准备发表的研究外,课题组正进一步利用来自ADIIsletCore与HPAP-T2D数据库的Patch-seq数据展开深入分析。该数据集规模庞大,涵盖了118名供体约6000个细胞的全转录组信息,及约88 000个电生理数据点。通过应用稳健的缺失数据插补、调控网络重建及多组学整合分析策略,课题组希望能够更系统地揭示糖尿病中α细胞功能障碍的异质性机制。
胰腺胰岛的节律性振荡源于δ细胞与α细胞间的相互作用
胰腺胰岛的节律性调控机制及其在糖尿病中的失调是理解胰腺功能的关键。任会霞教授课题组[7]通过体外和体内实验系统验证了胰腺胰岛的节律性振荡由δ细胞与α细胞协同调控,并发现糖尿病状态下,这种精密调控被破坏,血糖水平对振荡频率的调节能力出现异常。
体外研究
体外研究[7]表明,作为少数群体的δ细胞与α细胞构成了整个胰岛稳健节律的核心调控网络。α细胞是诱导快速钙振荡的关键,而δ细胞则负责维持固有的慢速钙振荡。这一作用通过其分泌的激素得以实现:胰高血糖素能将处于慢振荡的胰岛切换至快振荡模式,而生长抑素则能将快振荡的胰岛切换至慢振荡模式。两者通过这种拮抗性的组合调控,共同诱导出复杂的混合型钙振荡(图6)。
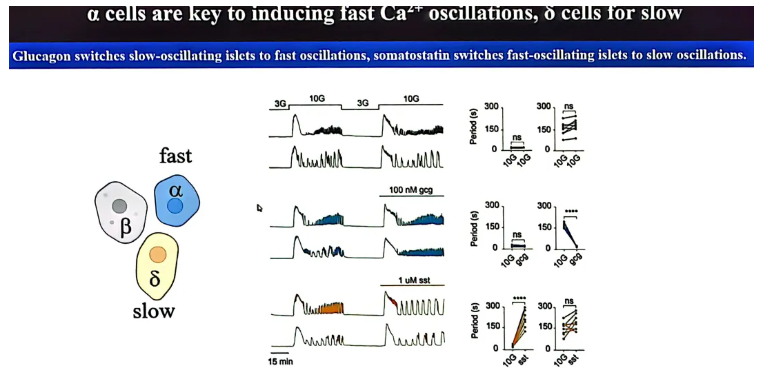
图6. 体外研究节律性振荡
体内研究
在体内环境中,血糖水平直接调节胰岛节律[7]。高血糖触发慢振荡,低血糖触发快振荡,且这一转换阈值与日常血糖稳态水平相关。如图7所示,研究通过在Ins-Cree+/-和GCaMP6ff/+转基因小鼠模型中注射胰岛素与葡萄糖以精确调控血糖,并利用活体成像技术对同一小鼠的20~200个胰岛进行长达6小时的同步观察。结果明确显示,在8~28 mM的血糖浓度范围内,胰岛钙活动频率随血糖水平升降而发生相应转换,进一步验证了血糖对胰岛振荡模式的动态调控作用。
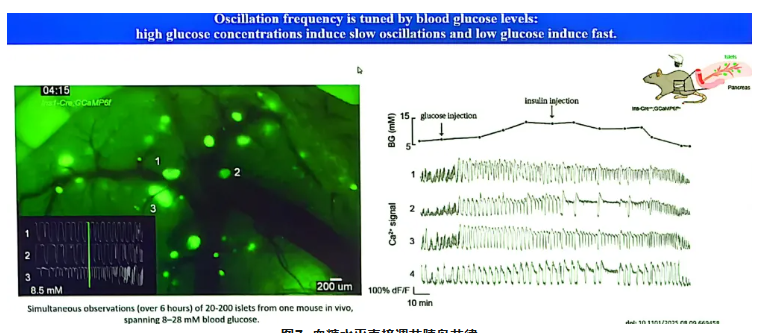
图7. 血糖水平直接调节胰岛节律
在糖尿病小鼠模型中,血糖调节胰岛振荡频率的功能出现严重受损。如图8所示,ob/ob糖尿病小鼠胰岛丧失了低血糖触发快速钙振荡的能力。健康小鼠的胰岛表现出随血糖水平变化的快慢振荡转换行为,而糖尿病胰岛不仅快速振荡机制受损,其对葡萄糖的敏感性也发生异常改变。
图8. 糖尿病小鼠胰岛振荡频率功能受损
结语
本次专题会系统呈现了胰岛内分泌细胞生物学的最新突破。三位教授团队分别从β细胞三维空间分布、α细胞功能异质性、δ/α细胞节律调控等维度,揭示了糖尿病中胰岛细胞网络协同失调的深层机制。展望未来,结合多组学、活体动态成像与人工智能等前沿策略,糖尿病复杂机制的神秘面纱有望进一步揭开。
参考文献
1. Hahn M, Nord C, Eriksson M et al. 3D imaging of human organs with micrometer resolution - applied to the endocrine pancreas. Communications Biology 2021; 4 (1): 1063.
2. Lehrstrand J, Davies WIL, Hahn M et al. Illuminating the complete ?-cell mass of the human pancreas- signifying a new view on the islets of Langerhans. Nat Commun 2024; 15 (1): 3318.
3. Lehrstrand J, Hahn M, Morén B et al. Deep tissue optical 3D imaging reveals preferential preservation of extra-islet β-cells in late-onset Type 1 Diabetes. bioRxiv 2025: 2025.2009.2003.673632.
4. Dai XQ, Camunas-Soler J, Briant LJB et al. Heterogenous impairment of α cell function in type 2 diabetes is linked to cell maturation state. Cell Metab 2022; 34 (2): 256-268.e255.
5. Avrahami D, Wang YJ, Schug J et al. Single-cell transcriptomics of human islet ontogeny defines the molecular basis of β-cell dedifferentiation in T2D. Mol Metab 2020; 42: 101057.
6. Arda HE, Li L, Tsai J et al. Age-Dependent Pancreatic Gene Regulation Reveals Mechanisms Governing Human β Cell Function. Cell Metab 2016; 23 (5): 909-920.
7. Deng Y, Fu Z, Wang X et al. Glycemia Shift Pancreatic Islets Rhythmicity via δ-α Cell in vivo, Impairment in Diabetes. bioRxiv 2025: 2025.2008.2009.669458.
2 comments
当前对糖尿病机制的认知正经历根本性转变,核心已超越β细胞功能障碍,转向β、α、δ细胞构成的精密调控网络失衡。2025年9月15日,第61届EASD年会在维也纳开幕,瑞典于默奥大学U. Ahlgren教授、加拿大阿尔伯塔大学P.E. MacDonald教授和中国首都医学科学创新中心任会霞教授,在专题会“胰岛内分泌细胞生物学新进展对1型和2型糖尿病的启示”上,多角度探讨胰岛细胞在健康和糖尿病状态下的前沿发现,对深入理解糖尿病发病机制、开发新治疗策略意义重大。
三维定量解析:胰腺β细胞的分布
在教科书中,正常胰岛的细胞组成大致按以下比例分布:分泌胰岛素的β细胞约占60%,是胰岛的主体;分泌胰高血糖素的α细胞约占30%;其余约10%为分泌胰多肽的PP细胞、分泌生长抑素的δ细胞以及分泌胃饥饿素的ε细胞等。然而,传统组织学方法难以在完整器官尺度上精确量化这些细胞群体的三维空间分布。U. Ahlgren教授课题组[1]提出了一种可在完整人体器官内重建抗体标记细胞分布、同时保留其原始三维结构的简易方法(图1)。利用该方法,课题组能够精确获取目标细胞的多种定量参数:包括体积、表面积、平均三维直径、大小分类及球形度等形态学数据;通过荧光强度值(如总和、均值、最大值、最小值及标准差)衡量其分子表达特性;同时在空间维度上,可获得细胞的三维坐标、与其他对象的距离,并可通过聚类分析评估其分布模式。

图1. 三维结构方法和多种定量参数
通过对整个腺体体积内的每个INS+结构进行三维体积分析[2],课题组获得了约2.26×106个胰岛的精确数据(以一名28岁、BMI 23.7 kg/m2、HbA1c 35 mmol/mol的男性供者胰腺为例,其INS+胰岛总体积达1.17 cm3)。分析不仅揭示了β细胞在胰腺头尾长轴上总体均匀的空间分布特征(平均密度约2.8%),更对每一个胰岛的体积、表面积、平均直径、形状(球形度)、三维坐标及与邻近胰岛的距离等参数进行了全面量化。另外,在25~49岁范围内的5个非糖尿病供者胰腺中,观察到了相似的β细胞质量分布模式,这表明该评估方法具有可靠性,并为在三维水平上精确量化β细胞质量与分布提供了重要依据(图2)。

图2. 人类全胰腺β细胞三维分布模式的量化与统计分析
另一项研究[3]通过三维成像技术揭示了LO-T1D(成人隐匿性自身免疫糖尿病)患者与正常人(ND)胰腺中β细胞分布的根本差异。该研究通过光学投影断层扫描和光片荧光显微镜对LO-T1D与正常对照(ND)的胰腺组织进行三维成像与量化分析,旨在详细评估LO-T1D患者残留β细胞质量的空间分布。结果显示,两者之间存在根本性差异(图3)。在ND胰腺中,高达92%的β细胞集中于胰岛结构内,而以簇状或散在形式存在的胰岛外β细胞占比极低(共约8%);相反,在LO-T1D胰腺中,残留的β细胞分布发生了彻底逆转,仅有15%与残存的胰岛结构相关,而高达85%以胰岛外形式存在,其中63%为散在单个细胞,22%为小型细胞簇。这种分布模式的剧变导致,与ND组相比,LO-T1D患者胰岛内B细胞密度减少到原来的1/1452,胰岛外B细胞密度减少到原来的1/23。可见,LO-T1D的病理特征并非单纯的β细胞总量减少,更关键的是其空间分布模式的根本性重构,即残留的β细胞主体由胰岛内转移至胰岛外。

图3. LO-T1D中残留的β细胞质量主要构成-胰岛外β细胞
深入解析胰岛在细胞与空间上的异质性,是连接其微观结构与宏观功能的核心环节,对糖尿病领域的基础研究与临床转化具有决定性意义。
T1DM和T2DM中的α细胞异质性
胰腺α细胞的功能紊乱是糖尿病病理机制中的重要环节,其胰高血糖素分泌失调现象已被确认,然而,导致该功能障碍的内在分子机制及其是否在所有α细胞中普遍发生,仍是尚未完全阐明的关键科学问题。MacDonald教授团队[4]整合电生理、转录组学与计算方法对人和小鼠α细胞进行系统研究,发现谱系与身份识别因子在α细胞中呈现异质性表达。在2型糖尿病(T2DM)中,高表达这些因子的α细胞亚群更易失去成熟度与电生理表型(图4)。免疫染色证实ARX、MAFB及胰高血糖素在蛋白水平上调;独立单细胞RNA测序数据[5]进一步显示,T2DM患者ARX高表达α细胞特异性上调幼年α细胞特征谱[6]、组织发育基因及β细胞样基因谱,热图分析亦揭示该幼年基因集在ARX高表达组中显著富集。

图4. α细胞成熟状态异常参与2型糖尿病中的α细胞功能障碍
另一方面,在1型糖尿病(T1DM)中,α细胞表现出功能异常与电生理特性改变(发表准备中)。具体而言,T1DM的α细胞呈现过度兴奋性,其特征为KATP通道功能紊乱,并对特定刺激产生异常增强的反应。这种α细胞功能障碍具有异质性,并与免疫信号通路上调、mTORC1通路激活及溶酶体调控紊乱相关联。值得注意的是,与α细胞功能障碍相关的转录本在T1DM遗传风险变异中显著富集,尤其在免疫和蛋白酶体通路中。此外,关键α细胞转录因子核输入受阻,与其特有的“电生理身份”受损密切相关(图5)。

图5. 1型糖尿病中的α细胞分子机制
除上述已发表/准备发表的研究外,课题组正进一步利用来自ADIIsletCore与HPAP-T2D数据库的Patch-seq数据展开深入分析。该数据集规模庞大,涵盖了118名供体约6000个细胞的全转录组信息,及约88 000个电生理数据点。通过应用稳健的缺失数据插补、调控网络重建及多组学整合分析策略,课题组希望能够更系统地揭示糖尿病中α细胞功能障碍的异质性机制。
胰腺胰岛的节律性振荡源于δ细胞与α细胞间的相互作用
胰腺胰岛的节律性调控机制及其在糖尿病中的失调是理解胰腺功能的关键。任会霞教授课题组[7]通过体外和体内实验系统验证了胰腺胰岛的节律性振荡由δ细胞与α细胞协同调控,并发现糖尿病状态下,这种精密调控被破坏,血糖水平对振荡频率的调节能力出现异常。
体外研究
体外研究[7]表明,作为少数群体的δ细胞与α细胞构成了整个胰岛稳健节律的核心调控网络。α细胞是诱导快速钙振荡的关键,而δ细胞则负责维持固有的慢速钙振荡。这一作用通过其分泌的激素得以实现:胰高血糖素能将处于慢振荡的胰岛切换至快振荡模式,而生长抑素则能将快振荡的胰岛切换至慢振荡模式。两者通过这种拮抗性的组合调控,共同诱导出复杂的混合型钙振荡(图6)。

图6. 体外研究节律性振荡
体内研究
在体内环境中,血糖水平直接调节胰岛节律[7]。高血糖触发慢振荡,低血糖触发快振荡,且这一转换阈值与日常血糖稳态水平相关。如图7所示,研究通过在Ins-Cree+/-和GCaMP6ff/+转基因小鼠模型中注射胰岛素与葡萄糖以精确调控血糖,并利用活体成像技术对同一小鼠的20~200个胰岛进行长达6小时的同步观察。结果明确显示,在8~28 mM的血糖浓度范围内,胰岛钙活动频率随血糖水平升降而发生相应转换,进一步验证了血糖对胰岛振荡模式的动态调控作用。

图7. 血糖水平直接调节胰岛节律
在糖尿病小鼠模型中,血糖调节胰岛振荡频率的功能出现严重受损。如图8所示,ob/ob糖尿病小鼠胰岛丧失了低血糖触发快速钙振荡的能力。健康小鼠的胰岛表现出随血糖水平变化的快慢振荡转换行为,而糖尿病胰岛不仅快速振荡机制受损,其对葡萄糖的敏感性也发生异常改变。
图8. 糖尿病小鼠胰岛振荡频率功能受损
结语
本次专题会系统呈现了胰岛内分泌细胞生物学的最新突破。三位教授团队分别从β细胞三维空间分布、α细胞功能异质性、δ/α细胞节律调控等维度,揭示了糖尿病中胰岛细胞网络协同失调的深层机制。展望未来,结合多组学、活体动态成像与人工智能等前沿策略,糖尿病复杂机制的神秘面纱有望进一步揭开。
参考文献
1. Hahn M, Nord C, Eriksson M et al. 3D imaging of human organs with micrometer resolution - applied to the endocrine pancreas. Communications Biology 2021; 4 (1): 1063.
2. Lehrstrand J, Davies WIL, Hahn M et al. Illuminating the complete ?-cell mass of the human pancreas- signifying a new view on the islets of Langerhans. Nat Commun 2024; 15 (1): 3318.
3. Lehrstrand J, Hahn M, Morén B et al. Deep tissue optical 3D imaging reveals preferential preservation of extra-islet β-cells in late-onset Type 1 Diabetes. bioRxiv 2025: 2025.2009.2003.673632.
4. Dai XQ, Camunas-Soler J, Briant LJB et al. Heterogenous impairment of α cell function in type 2 diabetes is linked to cell maturation state. Cell Metab 2022; 34 (2): 256-268.e255.
5. Avrahami D, Wang YJ, Schug J et al. Single-cell transcriptomics of human islet ontogeny defines the molecular basis of β-cell dedifferentiation in T2D. Mol Metab 2020; 42: 101057.
6. Arda HE, Li L, Tsai J et al. Age-Dependent Pancreatic Gene Regulation Reveals Mechanisms Governing Human β Cell Function. Cell Metab 2016; 23 (5): 909-920.
7. Deng Y, Fu Z, Wang X et al. Glycemia Shift Pancreatic Islets Rhythmicity via δ-α Cell in vivo, Impairment in Diabetes. bioRxiv 2025: 2025.2008.2009.669458.
2 comments











 京公网安备 11010502033361号
京公网安备 11010502033361号
发布留言