编者按

根据世界卫生组织估计,全球约39%的成年人处于超重状态,13%的成年人患有肥胖,部分地区的患病率已超过40%。肥胖和超重是全球范围内的重要公共健康问题,与多种疾病密切相关,包括2型糖尿病(T2DM)和心血管疾病。除肥胖和动脉粥样硬化外,胰岛素抵抗是T2DM的典型特征,而脂肪分布在决定个体胰岛素敏感性方面起着关键作用。人体脂肪主要分布于VAT和皮下脂肪组织(SAT),二者具有不同的代谢特征,其中内脏脂肪与胰岛素抵抗、糖脂代谢紊乱密切相关,其增加也是评估整体心血管疾病风险的重要因素,可显著提高高血压和缺血性心脏病的发生风险。
在药物治疗方面,美国临床内分泌医师协会2016年发布的指南推荐奥利司他、氯卡色林、利拉鲁肽、纳曲酮–安非他酮和苯丁胺–托吡酯用于成人肥胖的长期治疗。然而,氯卡色林已于2020年因潜在癌症风险被撤回。2021年,每周一次皮下注射、剂量为2.4mg的司美格鲁肽获得美国食品药品监督管理局(FDA)批准,用于配合限制热量饮食和增加体育锻炼的长期体重管理。此外,降糖药物如普兰林肽、二甲双胍以及SGLT-2抑制剂在肥胖管理中也显示出一定潜力,研究还提示左卡尼汀可降低体重、体重指数(BMI)和腰围,有望作为肥胖管理的辅助治疗手段。
尽管已有多种药物获FDA批准用于肥胖治疗,但不同药物对脂肪分布,尤其是内脏脂肪和皮下脂肪的影响仍缺乏系统比较。既往研究显示,利拉鲁肽可有效减少内脏脂肪,且其下降与糖化血红蛋白水平的降低显著相关。总体来看,多种减重药物可能通过调节不同脂肪库的脂质代谢改变体脂分布,从而改善代谢紊乱及大血管并发症风险。然而,减重药物对脂肪分布的影响长期未受到足够关注。因此,本研究对相关随机对照试验进行了系统评价和网络Meta分析,重点关注脂肪分布相关结局指标。
研究设计和方法:为什么采用网络Meta分析?
本研究系统检索了PubMed、Embase及Cochrane Library数据库,纳入截至2023年5月发表的随机对照试验(RCT),最终共纳入39篇文献、41项RCT,总样本量为2741 例,平均随访时间约29周。研究对象涵盖肥胖、T2DM及多囊卵巢综合征(PCOS)等不同人群类型。研究主要结局指标为VAT和SAT的变化,次要结局包括体重和腰围的改变。
在研究方法上,采用网络Meta分析对不同减重/代谢药物的效果进行综合比较,不仅评估了各药物与安慰剂之间的差异,也实现了不同药物之间的间接比较,并通过累积排序曲线下面积(SUCRA)评分值对疗效进行排序,从而提高证据整合的效率和比较结果的整体性。本研究共评估了六类具有减重或代谢改善潜力的药物,包括GLP-1受体激动剂、SGLT-2抑制剂、二甲双胍、纳曲酮–安非他酮复方、奥利司他和左旋肉碱,既涵盖传统抗肥胖药物,也纳入临床中常用于代谢管理且具有减重作用的降糖药物,使研究结论更贴近真实世界的临床应用场景。
研究结果:不同减重药物对脂肪分布及相关指标的影响
在主要结局指标方面,共有40项随机对照试验(2689例患者)报告了VAT数据。网络Meta分析显示,与安慰剂相比,GLP-1受体激动剂和SGLT-2抑制剂可显著降低VAT,其效应值分别为-0.90(95%CI:-1.32~-0.47) 和-0.66(95%CI:-1.22~-0.10)。相比之下,奥利司他、纳曲酮–安非他酮、二甲双胍和左卡尼汀对VAT的影响均未达到统计学显著性(图1)。SUCRA评分结果显示,SGLT-2抑制剂和GLP-1受体激动剂位列降低VAT效果最优的三种药物之中。
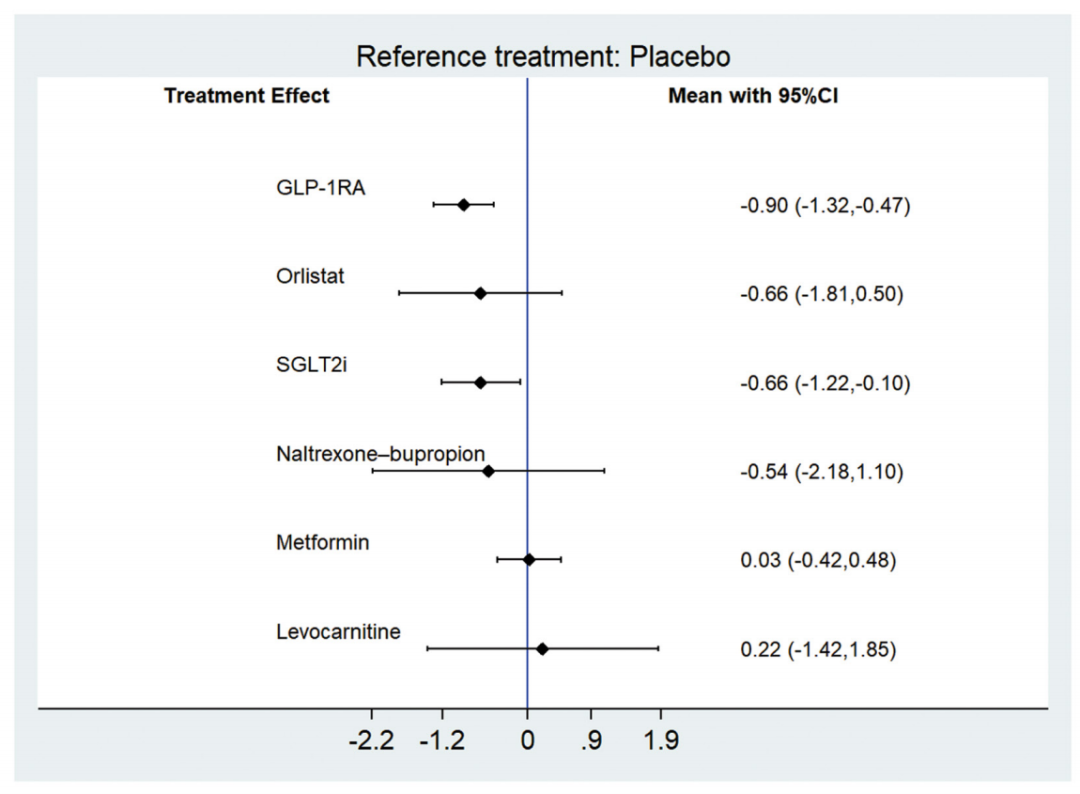
图1.与安慰剂相比,不同减重药物VAT的Meta分析结果
在SAT方面,共有28项试验(1682例患者) 报告相关数据。结果显示,与安慰剂相比,仅GLP-1受体激动剂可显著降低SAT,其效应值为-1.01(95%CI:-1.58~-0.43)。而 SGLT-2抑制剂、奥利司他、纳曲酮–安非他酮、二甲双胍和左卡尼汀对SAT的影响均无统计学显著性(图2)。SUCRA排名结果表明,GLP-1受体激动剂在降低SAT方面排名最高。
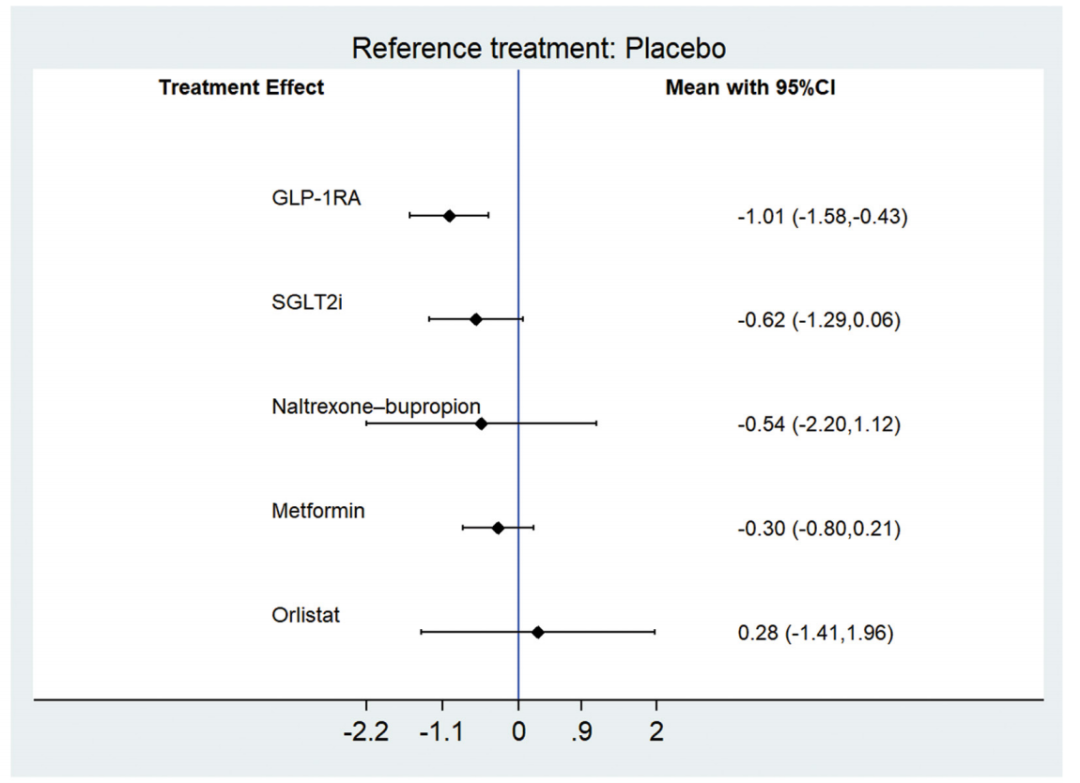
图2.与安慰剂相比,不同减重药物SAT的Meta分析结果
在次要结局指标中,共有33项研究(2235例患者) 报告了体重变化。与安慰剂相比,纳曲酮–安非他酮、GLP-1受体激动剂、SGLT-2抑制剂和二甲双胍均可显著降低体重,其减重幅度分别为-5.60kg(95%CI:-8.64~-2.56)、-4.73kg(95%CI:-5.58~-3.88)、-3.20kg(95%CI:-4.69~-1.72)和-1.93kg(95%CI:-3.01~-0.85)。而奥利司他和左卡尼汀治疗后体重变化无统计学显著性(图3)。SUCRA评分显示,GLP-1受体激动剂、SGLT-2抑制剂和纳曲酮–安非他酮在减重效果方面效果最佳。
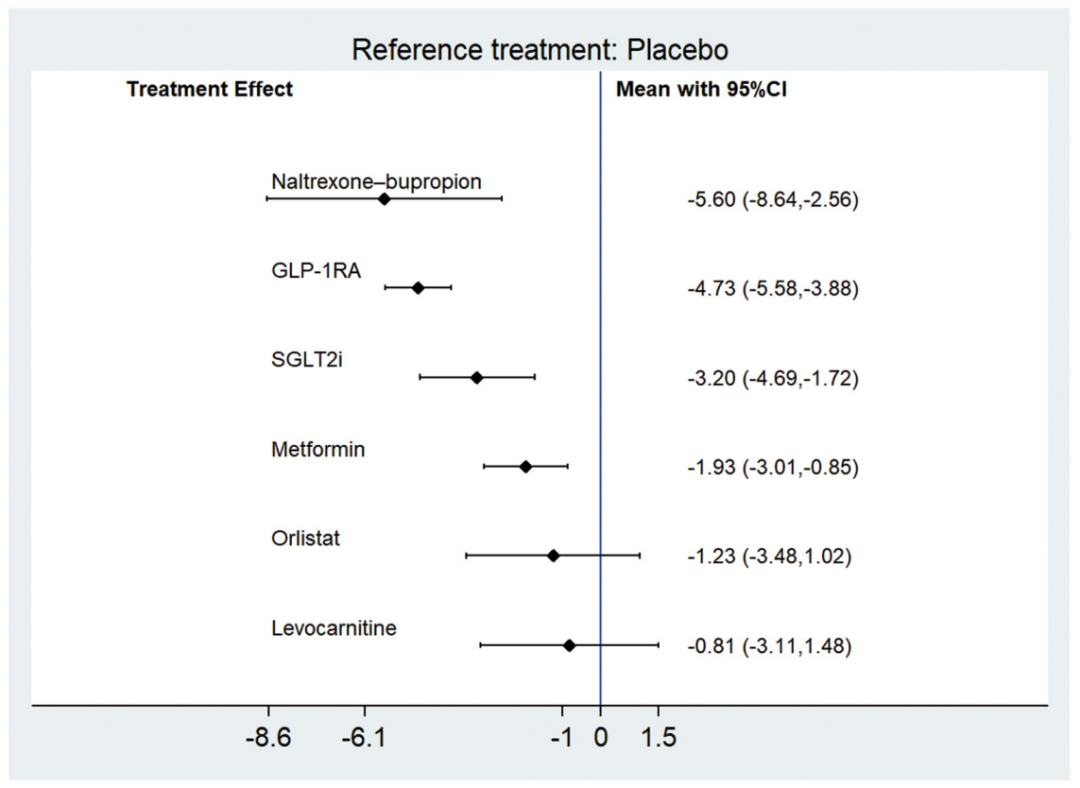
图3.与安慰剂相比,不同减重药物体重变化的Meta分析结果
在腰围变化方面,共有26项试验(1860例患者) 提供相关数据。结果显示,与安慰剂相比,GLP-1受体激动剂、纳曲酮–安非他酮、SGLT-2抑制剂和二甲双胍均可显著减小腰围,其效应值分别为-4.89cm(95%CI:-5.42~-4.36)、-3.50cm(95%CI:-6.41~-0.59)、-2.96cm(95%CI:-4.99~-0.92)和-1.18cm(95%CI:-1.41~-0.95);左卡尼汀对腰围的影响无统计学显著性(图4)。SUCRA排名结果显示,纳曲酮–安非他酮、SGLT-2抑制剂和GLP-1受体激动剂为降低腰围效果最优的三种药物。
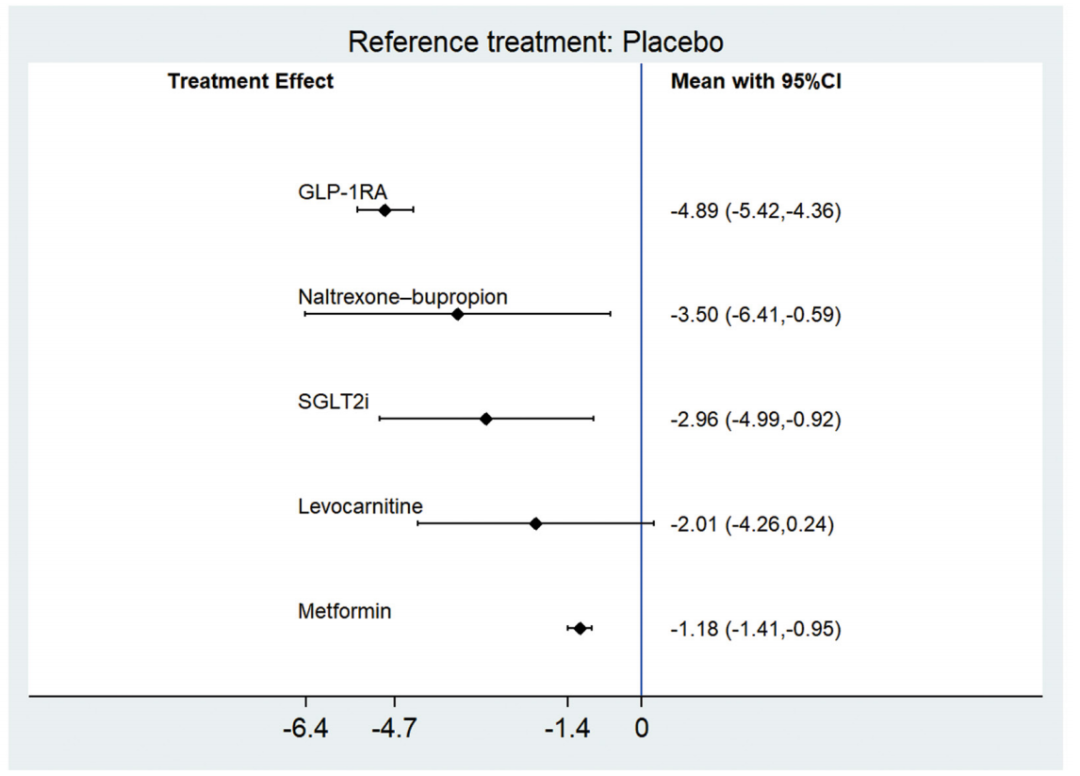
图4.与安慰剂相比,不同减重药物腰围变化的Meta分析结果
采用节点拆分法和闭环不一致性分析评估网络一致性与异质性,结果显示直接与间接比较之间无显著整体或局部不一致性,且各结局闭环的95%CI接近0;敏感性分析在多种排除条件下结果与主要分析一致,GLP-1受体激动剂和SGLT-2抑制剂仍可降低VAT,而仅GLP-1受体激动剂可减少SAT,漏斗图亦未发现小样本效应。
研究讨论:减重药物对脂肪分布的差异化影响
本研究通过网络Meta分析系统评估了减重药物对体脂分布的影响。尽管仅纳入了6种减重或代谢相关药物,包括SGLT-2抑制剂、奥利司他、纳曲酮–安非他酮、左卡尼汀、二甲双胍和GLP-1受体激动剂,但结果显示,与其他降糖药或安慰剂相比,GLP-1 受体激动剂可同时显著减少VAT和SAT,并降低体重和腰围,提示其在脂肪分布重塑方面具有综合优势。
越来越多证据表明,VAT在多种代谢性疾病的发生发展中发挥关键作用。VAT过多不仅可干扰脂肪因子分泌,参与非酒精性脂肪性肝炎和代谢综合征的病理过程,其高度代谢活性也被认为是肥胖和冠心病患者慢性炎症的重要来源。此外,VAT已被证实可独立预测T2DM的发病风险。因此,对于T2DM患者,选择既能改善糖代谢又能减少VAT的治疗策略尤为重要,本研究结果为GLP-1受体激动剂在改变脂肪分布方面的作用提供了循证支持。
关于作用机制,既往研究提示GLP-1受体激动剂可能通过多途径影响脂肪分布。研究发现,肥胖的糖尿病患者腹腔内脂肪细胞中GLP-1受体表达高于皮下脂肪细胞,提示其可能通过激活受体诱导脂肪细胞脂解。已有研究显示,高浓度GLP-1可增强脂肪细胞脂解,而低浓度时可能促进脂肪生成。此外,GLP-1通过延缓胃排空,也可能在能量摄入和体脂分布调节中发挥作用。
本研究还发现,SGLT-2抑制剂可显著减少VAT,但对SAT无统计学显著影响,且敏感性分析结果与总体结论一致。该结果与部分既往研究存在差异,可能与本研究中部分试验随访时间较短有关。动物实验提示,SGLT-2抑制剂可能通过激活肝–脑–脂肪轴、启动糖原耗竭信号而促进脂解,同时降低脂肪组织中GLUT4的表达,使底物利用由脂质储存向葡萄糖氧化转变。作为首个系统评估减重药物对VAT和SAT影响的网络荟萃分析,本研究为理解不同减重药物在脂肪分布方面的差异提供了新的循证依据,但仍需进一步大样本、长期随访的随机对照试验加以验证。
结语
综上所述,该项网络Meta分析显示,不同减重药物在脂肪分布重塑方面存在明显差异。相较于单纯关注体重下降,内脏脂肪与皮下脂肪的变化可能更能反映真实的代谢获益。在肥胖及代谢性疾病管理中,基于脂肪分布特征进行更精细化的药物选择,或将成为未来临床决策的重要方向。为进一步支持降低肥胖的长期并发症风险,需要开展更多关注脂肪分布的临床研究。
参考文献
1.Qiao X, Wang W, Cao J, Guo L, Pan Q. Efficacy of Weight-Lowering Agents on Fat Distribution: A Systematic Review and Network Meta-Analysis of Randomized Controlled Trials. Obes Rev. 2026 Jan 19:e70100. doi: 10.1111/obr.70100. Epub ahead of print. PMID: 41554634.2 comments











 京公网安备 11010502033361号
京公网安备 11010502033361号
发布留言