编者按:目前,糖尿病肾病(DKD)已成为我国慢性肾脏病(CKD)的主要病因,患病率持续攀升,疾病负担加剧。尽管接受肾素-血管紧张素系统抑制剂(RASi)等传统药物治疗,DKD患者仍面临心肾残余风险。非奈利酮是新型非甾体类盐皮质激素受体拮抗剂(MRA),在大型Ⅲ期临床试验中展现出卓越的心肾保护作用,其在真实世界中的疗效与安全性也是临床关注的热点。近期,现任职于河北省中医院内分泌科的杨爱格教授,在河北医科大学第一医院内分泌科任职期间带领团队开展的真实世界研究,验证了非奈利酮在常规治疗基础上的显著疗效,从尿蛋白、肾小管损伤标志物及炎症因子等多维度,深入探讨其作用机制,为DKD综合管理提供了重要参考。

专家简介
杨爱格 教授
河北省中医院内分泌科
主任医师 硕士生导师
曾任职于河北医科大学第一医院内分泌科
国际血管联盟中国分会糖尿病足专业委员会 委员
中国医疗保健国际交流促进会外周血管医学分会 常务委员
中国民族医药协会体重管理专业委员会 常务理事
中国女医师协会精准医学专业委员会 委员
河北省急救医学会糖尿病健康管理专业委员会 副主任委员
河北省急救医学会糖尿病与肥胖专业委员会 副主任委员
河北省健康教育与康复学会 内分泌专业委员会 副主任委员
河北省预防医学会内分泌代谢与生长发育疾病专委会 副主任委员
河北省医学会骨质疏松和骨矿盐疾病学分会 委员
河北省医学会内分泌学分会 委员
河北省急救医学会内分泌专业委员会 常务委员
河北省女医师协会内分泌代谢病专业委员会 常务委员
河北省中西医结合学会糖尿病足专业委员会 常务委员
研究背景与设计
在过去几十年里,人们对DKD的病理生理和治疗认识不断进步。研究发现,DKD的发生发展与盐皮质激素受体(MR)的过度激活密切相关。MR在肾小球、肾小管等多种肾细胞中广泛表达,过度激活可促进炎症、纤维化和氧化应激,加速肾功能恶化。非奈利酮作为非甾体类MRA,相较于传统甾体类MRA,具有更高的选择性和特异性。非奈利酮与MR结合后,减轻氧化应激,减少下游促炎和促纤维化因子的表达,从而延缓心肾疾病进展。目前已有大型III期临床研究证实其心肾保护作用,真实世界研究将为日常临床实践环境中的疗效和安全性提供进一步数据。
本研究为单中心回顾性队列研究,48例符合标准的DKD患者[基线尿白蛋白/肌酐比值(UACR)≥30 mg/g,估算肾小球滤过率(eGFR)≥25 ml/(min·1.73 m2)],接受至少6个月非奈利酮治疗。研究主要评估非奈利酮对UACR的影响,同时检测尿β2-微球蛋白(β2-MG)、促炎细胞因子[如白细胞介素-1β(IL-1β)、肿瘤坏死因子-α(TNF-α)、干扰素-γ(IFN-γ)]及抗炎因子白细胞介素-10(IL-10)的变化,并监测安全性指标,包括eGFR、血钾和不良事件。此外,研究还对患者进行亚组分析,分为微量白蛋白尿组(基线UACR 30~<300 mg/g)和大量白蛋白尿组(基线UACR≥300 mg/g),以深入探讨非奈利酮在不同病情阶段的作用。
非奈利酮显著降低UACR水平
UACR作为CKD的关键指标,其变化趋势在研究中备受关注。结果显示,患者接受非奈利酮治疗3个月时UACR已出现显著下降,6个月时维持稳定:基线时中位数为363.92 mg/g,3个月后降至101.47 mg/g(P<0.001),6个月时进一步下降至94.31 mg/g(P<0.001)(图1)。
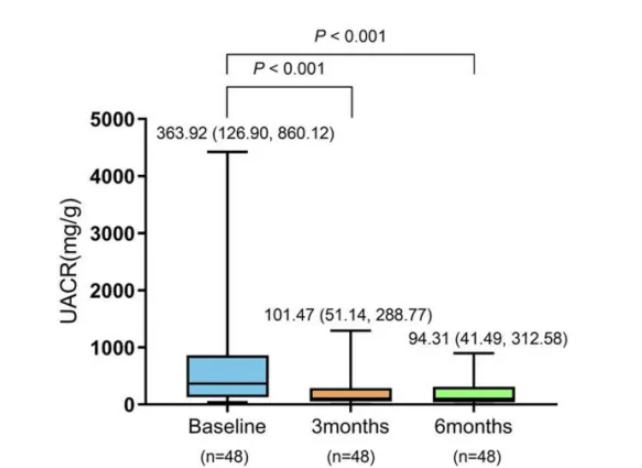
图1. 非奈利酮对患者UACR的影响
该结果与既往研究一致。FIDELITY分析显示,非奈利酮治疗4个月后UACR较基线显著降低32%,疗效持续[2]。然而,本研究UACR降幅更大,这可能与部分患者联用RASi、钠-葡萄糖共转运蛋白2抑制剂(SGLT2i)和/或胰高血糖素样肽-1受体激动剂(GLP-1RA)有关[1]。这一推测在CONFIDENCE研究同样得到了证实,非奈利酮联合恩格列净治疗180天UACR下降52%,优于单药,且第2周即达30%降幅[3],提示早期联合干预可能带来更优的肾脏保护效应。此外,一项真实世界研究也显示,非奈利酮治疗1个月UACR下降32%,6个月下降73%,改善持续[4],这与本研究中观察到的UACR持续改善趋势高度吻合,共同证实了非奈利酮在真实世界环境中的持久疗效。
微量和大量白蛋白尿患者均获益
亚组分析进一步揭示无论基线蛋白尿水平如何,非奈利酮均带来一致性获益:在微量白蛋白尿组中,基线中位UACR为121.83 mg/g,治疗3个月时显著下降至56.99 mg/g(P<0.001),6个月时进一步降至54.50 mg/g(P<0.001)(图2),降幅分别为48.37%±27.22%和50.99%±28.19%;在大量白蛋白尿组中,基线中位UACR为802.57 mg/g,3个月时显著降低至287.01 mg/g(P<0.001),6个月时降至285.82 mg/g(P<0.001)(图3),降幅分别达到64.26%±26.84%和71.11%±20.26%。这说明伴微量白蛋白尿和大量白蛋白尿患者均可从非奈利酮治疗中获益,基线尿蛋白水平较高的患者在接受治疗后可能实现更大幅度的蛋白尿改善。
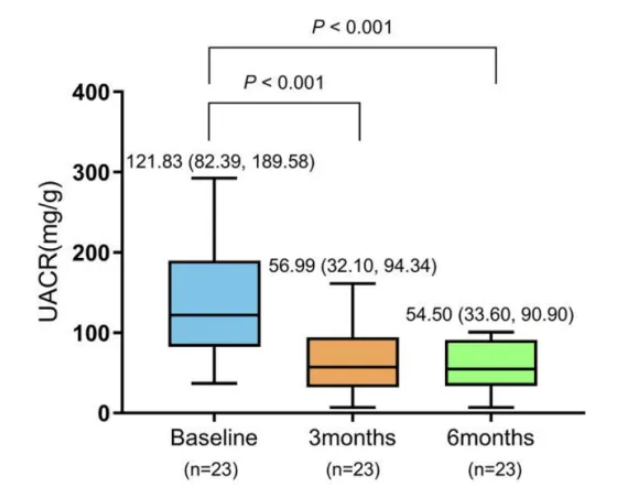
图2. 非奈利酮对微量白蛋白尿患者UACR的影响
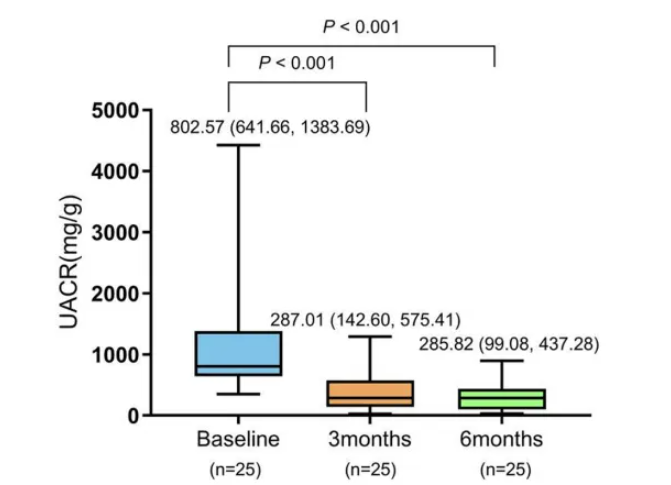
图3. 非奈利酮对大量白蛋白尿患者UACR的影响
非奈利酮治疗可能改善肾小管损伤
除肾小球损伤外,肾小管损伤也是DKD的重要病生理表现。尿β2-MG是肾小管损伤的敏感标志物,其排泄增加提示肾小管功能受损。研究表明,尿β2-MG水平与肾小管间质损伤程度相关,且与尿白蛋白水平呈正相关。本研究中,治疗后所有患者的尿β2-MG水平均显著下降:基线中位数0.30 mg/L,3个月降至0.14 mg/L(P<0.001),6个月降至0.10 mg/L(P<0.001)(图4)。
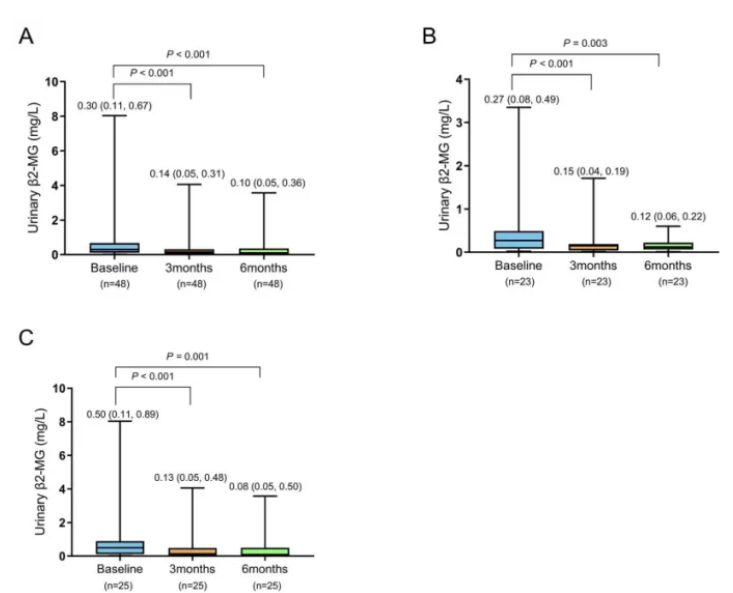
图4. 非奈利酮对尿β2-MG水平的影响,(A)所有患者,(B)微量白蛋白尿患者,(C)大量白蛋白尿患者
值得注意的是,虽然微量和大量白蛋白尿组的尿β2-MG水平在治疗后均显著降低,但两组间降低率无显著差异(P>0.05)。这可能提示非奈利酮对肾小管的保护作用在不同蛋白尿程度患者中相对一致。这一结果表明,非奈利酮可能通过抑制促炎和促纤维化因子表达、抑制氧化应激、改善线粒体功能障碍等机制,延缓肾小管损伤。结合本研究中超过半数患者联用RASi、SGLT2i和/或GLP-1RA的情况,这些发现共同提示,非奈利酮与这些药物联用可协同改善肾小管损伤,从而全面延缓DKD进展。
促炎因子水平显著改善
此外,多种促炎因子(IL-1β、TNF-α和IFN-γ等)也在DKD进展中发挥重要作用。结果显示,非奈利酮治疗可使促炎因子显著改善:IL-1β基线中位数2.33 pg/ml,3个月降至1.18 pg/ml(P<0.001),6个月降至1.12 pg/ml(P<0.001);TNF-α从2.64 pg/ml降至2.00 pg/ml(P=0.001)和1.28 pg/ml(P<0.001);IFN-γ从2.20 pg/ml降至1.46 pg/ml(P<0.001)和1.14 pg/ml(P<0.001);抗炎因子IL-10从3.28 pg/ml变化至3.54 pg/ml(
P=0.251)和3.16 pg/ml(P=0.774)(表1)。
表1. 与基线比较,所有患者促炎因子水平随时间的变化
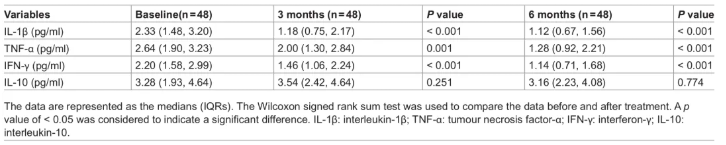
这一发现与既往研究结果一致,表明非奈利酮可能通过抑制MR过度激活,减少促炎细胞因子的表达,从而减轻炎症反应,保护肾脏。同时,RASi、SGLT2i和GLP-1RA也可通过多种机制发挥抗炎作用,与非奈利酮联用可能产生协同效应。
安全性分析:可控的不良反应
除疗效外,安全性也是DKD治疗中的重要考量。本研究中,非奈利酮显示出良好的安全性。治疗1个月时eGFR虽有下降,但降低幅度未超过基线的30%[基线中位数97.79 ml/(min·1.73 m2),1个月88.55 ml/(min·1.73 m2),P<0.05],且在3个月[91.34 ml/(min·1.73 m2)]和6个月[96.04 ml/(min·1.73 m2)]时回升至基线水平(P>0.05),并保持稳定,这提示初期下降可能为调节肾小球囊内压所导致的血流动力学相关的一过性变化。值得注意的是,即使超过半数患者联用RASi和/或SGLT2i,未见肾功能持续恶化。
同时,在治疗1个月后观察到血钾水平高于基线水平(P<0.001),但在治疗3个月和6个月时与1个月相比无显著差异(P>0.05),趋于稳定。究其原因,可能与联用RASi导致的双重肾素-血管紧张素-醛固酮系统(RAAS)抑制相关。本研究中仅2例患者因高钾血症(>5.5 mmol/L)停药,但均为老年伴单侧肾动脉闭塞或长期肾功能不全患者。因此,临床实践中,应密切监测接受非奈利酮治疗患者的血钾水平,特别是同时接受RASi治疗以及具有肾动脉狭窄、长期慢性肾功能不全等特殊因素的患者。
此外,其他安全性指标方面,如血压、谷丙转氨酶(ALT)和谷草转氨酶(AST)等无显著变化(P>0.05),随访期间也未观察到低血压、过敏、肝功能异常、乳房痛或男性乳腺发育等不良事件。
临床启示与展望
本研究为非奈利酮治疗DKD提供了真实世界临床证据。在本研究中,超过一半患者接受了非奈利酮与RASi和/或SGLT2i的联合治疗,三分之一患者接受与GLP-1RA联合应用。结果显示,多种非奈利酮联合方案均能显著降低尿蛋白水平,改善肾功能,延缓疾病进展,对微量和大量白蛋白尿患者均效果显著,支持心肾获益多支柱药物联合治疗DKD的价值与可行性。研究还提示,非奈利酮联合方案可通过改善炎症反应来延缓肾脏疾病的进展。本研究尚存在单中心、样本量小、缺乏随机对照等局限,未来需开展更大样本量、更长随访的随机对照试验,以进一步评估非奈利酮对DKD的治疗效果,并不断总结非奈利酮在临床实践中的个体化治疗经验,实现DKD患者的最大获益。
参考文献:
[1] Song J, et al. Effect of finerenone on urinary protein and inflammatory factor levels in type 2 diabetes mellitus patients with diabetic kidney disease. PLoS One. 2025 Aug 18;20(8):e0329965.
[2] Agarwal R, et al. Cardiovascular and kidney outcomes with finerenone in patients with type 2 diabetes and chronic kidney disease: the FIDELITY pooled analysis. Eur Heart J. 2022 Feb 10;43(6):474-484.
[3] Agarwal R, et al. Finerenone with Empagliflozin in Chronic Kidney Disease and Type 2 Diabetes. N Engl J Med. 2025 Aug 7;393(6):533-543.
[4] Zhou J, et al. Effectiveness and safety of finerenone in diabetic kidney disease patients: a real-world observational study from China. Ren Fail. 2024 Dec;46(2):2400541.
2 comments

专家简介
杨爱格 教授
河北省中医院内分泌科
主任医师 硕士生导师
曾任职于河北医科大学第一医院内分泌科
国际血管联盟中国分会糖尿病足专业委员会 委员
中国医疗保健国际交流促进会外周血管医学分会 常务委员
中国民族医药协会体重管理专业委员会 常务理事
中国女医师协会精准医学专业委员会 委员
河北省急救医学会糖尿病健康管理专业委员会 副主任委员
河北省急救医学会糖尿病与肥胖专业委员会 副主任委员
河北省健康教育与康复学会 内分泌专业委员会 副主任委员
河北省预防医学会内分泌代谢与生长发育疾病专委会 副主任委员
河北省医学会骨质疏松和骨矿盐疾病学分会 委员
河北省医学会内分泌学分会 委员
河北省急救医学会内分泌专业委员会 常务委员
河北省女医师协会内分泌代谢病专业委员会 常务委员
河北省中西医结合学会糖尿病足专业委员会 常务委员
研究背景与设计
在过去几十年里,人们对DKD的病理生理和治疗认识不断进步。研究发现,DKD的发生发展与盐皮质激素受体(MR)的过度激活密切相关。MR在肾小球、肾小管等多种肾细胞中广泛表达,过度激活可促进炎症、纤维化和氧化应激,加速肾功能恶化。非奈利酮作为非甾体类MRA,相较于传统甾体类MRA,具有更高的选择性和特异性。非奈利酮与MR结合后,减轻氧化应激,减少下游促炎和促纤维化因子的表达,从而延缓心肾疾病进展。目前已有大型III期临床研究证实其心肾保护作用,真实世界研究将为日常临床实践环境中的疗效和安全性提供进一步数据。
本研究为单中心回顾性队列研究,48例符合标准的DKD患者[基线尿白蛋白/肌酐比值(UACR)≥30 mg/g,估算肾小球滤过率(eGFR)≥25 ml/(min·1.73 m2)],接受至少6个月非奈利酮治疗。研究主要评估非奈利酮对UACR的影响,同时检测尿β2-微球蛋白(β2-MG)、促炎细胞因子[如白细胞介素-1β(IL-1β)、肿瘤坏死因子-α(TNF-α)、干扰素-γ(IFN-γ)]及抗炎因子白细胞介素-10(IL-10)的变化,并监测安全性指标,包括eGFR、血钾和不良事件。此外,研究还对患者进行亚组分析,分为微量白蛋白尿组(基线UACR 30~<300 mg/g)和大量白蛋白尿组(基线UACR≥300 mg/g),以深入探讨非奈利酮在不同病情阶段的作用。
非奈利酮显著降低UACR水平
UACR作为CKD的关键指标,其变化趋势在研究中备受关注。结果显示,患者接受非奈利酮治疗3个月时UACR已出现显著下降,6个月时维持稳定:基线时中位数为363.92 mg/g,3个月后降至101.47 mg/g(P<0.001),6个月时进一步下降至94.31 mg/g(P<0.001)(图1)。

图1. 非奈利酮对患者UACR的影响
该结果与既往研究一致。FIDELITY分析显示,非奈利酮治疗4个月后UACR较基线显著降低32%,疗效持续[2]。然而,本研究UACR降幅更大,这可能与部分患者联用RASi、钠-葡萄糖共转运蛋白2抑制剂(SGLT2i)和/或胰高血糖素样肽-1受体激动剂(GLP-1RA)有关[1]。这一推测在CONFIDENCE研究同样得到了证实,非奈利酮联合恩格列净治疗180天UACR下降52%,优于单药,且第2周即达30%降幅[3],提示早期联合干预可能带来更优的肾脏保护效应。此外,一项真实世界研究也显示,非奈利酮治疗1个月UACR下降32%,6个月下降73%,改善持续[4],这与本研究中观察到的UACR持续改善趋势高度吻合,共同证实了非奈利酮在真实世界环境中的持久疗效。
微量和大量白蛋白尿患者均获益
亚组分析进一步揭示无论基线蛋白尿水平如何,非奈利酮均带来一致性获益:在微量白蛋白尿组中,基线中位UACR为121.83 mg/g,治疗3个月时显著下降至56.99 mg/g(P<0.001),6个月时进一步降至54.50 mg/g(P<0.001)(图2),降幅分别为48.37%±27.22%和50.99%±28.19%;在大量白蛋白尿组中,基线中位UACR为802.57 mg/g,3个月时显著降低至287.01 mg/g(P<0.001),6个月时降至285.82 mg/g(P<0.001)(图3),降幅分别达到64.26%±26.84%和71.11%±20.26%。这说明伴微量白蛋白尿和大量白蛋白尿患者均可从非奈利酮治疗中获益,基线尿蛋白水平较高的患者在接受治疗后可能实现更大幅度的蛋白尿改善。

图2. 非奈利酮对微量白蛋白尿患者UACR的影响

图3. 非奈利酮对大量白蛋白尿患者UACR的影响
非奈利酮治疗可能改善肾小管损伤
除肾小球损伤外,肾小管损伤也是DKD的重要病生理表现。尿β2-MG是肾小管损伤的敏感标志物,其排泄增加提示肾小管功能受损。研究表明,尿β2-MG水平与肾小管间质损伤程度相关,且与尿白蛋白水平呈正相关。本研究中,治疗后所有患者的尿β2-MG水平均显著下降:基线中位数0.30 mg/L,3个月降至0.14 mg/L(P<0.001),6个月降至0.10 mg/L(P<0.001)(图4)。

图4. 非奈利酮对尿β2-MG水平的影响,(A)所有患者,(B)微量白蛋白尿患者,(C)大量白蛋白尿患者
值得注意的是,虽然微量和大量白蛋白尿组的尿β2-MG水平在治疗后均显著降低,但两组间降低率无显著差异(P>0.05)。这可能提示非奈利酮对肾小管的保护作用在不同蛋白尿程度患者中相对一致。这一结果表明,非奈利酮可能通过抑制促炎和促纤维化因子表达、抑制氧化应激、改善线粒体功能障碍等机制,延缓肾小管损伤。结合本研究中超过半数患者联用RASi、SGLT2i和/或GLP-1RA的情况,这些发现共同提示,非奈利酮与这些药物联用可协同改善肾小管损伤,从而全面延缓DKD进展。
促炎因子水平显著改善
此外,多种促炎因子(IL-1β、TNF-α和IFN-γ等)也在DKD进展中发挥重要作用。结果显示,非奈利酮治疗可使促炎因子显著改善:IL-1β基线中位数2.33 pg/ml,3个月降至1.18 pg/ml(P<0.001),6个月降至1.12 pg/ml(P<0.001);TNF-α从2.64 pg/ml降至2.00 pg/ml(P=0.001)和1.28 pg/ml(P<0.001);IFN-γ从2.20 pg/ml降至1.46 pg/ml(P<0.001)和1.14 pg/ml(P<0.001);抗炎因子IL-10从3.28 pg/ml变化至3.54 pg/ml(
P=0.251)和3.16 pg/ml(P=0.774)(表1)。
表1. 与基线比较,所有患者促炎因子水平随时间的变化

这一发现与既往研究结果一致,表明非奈利酮可能通过抑制MR过度激活,减少促炎细胞因子的表达,从而减轻炎症反应,保护肾脏。同时,RASi、SGLT2i和GLP-1RA也可通过多种机制发挥抗炎作用,与非奈利酮联用可能产生协同效应。
安全性分析:可控的不良反应
除疗效外,安全性也是DKD治疗中的重要考量。本研究中,非奈利酮显示出良好的安全性。治疗1个月时eGFR虽有下降,但降低幅度未超过基线的30%[基线中位数97.79 ml/(min·1.73 m2),1个月88.55 ml/(min·1.73 m2),P<0.05],且在3个月[91.34 ml/(min·1.73 m2)]和6个月[96.04 ml/(min·1.73 m2)]时回升至基线水平(P>0.05),并保持稳定,这提示初期下降可能为调节肾小球囊内压所导致的血流动力学相关的一过性变化。值得注意的是,即使超过半数患者联用RASi和/或SGLT2i,未见肾功能持续恶化。
同时,在治疗1个月后观察到血钾水平高于基线水平(P<0.001),但在治疗3个月和6个月时与1个月相比无显著差异(P>0.05),趋于稳定。究其原因,可能与联用RASi导致的双重肾素-血管紧张素-醛固酮系统(RAAS)抑制相关。本研究中仅2例患者因高钾血症(>5.5 mmol/L)停药,但均为老年伴单侧肾动脉闭塞或长期肾功能不全患者。因此,临床实践中,应密切监测接受非奈利酮治疗患者的血钾水平,特别是同时接受RASi治疗以及具有肾动脉狭窄、长期慢性肾功能不全等特殊因素的患者。
此外,其他安全性指标方面,如血压、谷丙转氨酶(ALT)和谷草转氨酶(AST)等无显著变化(P>0.05),随访期间也未观察到低血压、过敏、肝功能异常、乳房痛或男性乳腺发育等不良事件。
临床启示与展望
本研究为非奈利酮治疗DKD提供了真实世界临床证据。在本研究中,超过一半患者接受了非奈利酮与RASi和/或SGLT2i的联合治疗,三分之一患者接受与GLP-1RA联合应用。结果显示,多种非奈利酮联合方案均能显著降低尿蛋白水平,改善肾功能,延缓疾病进展,对微量和大量白蛋白尿患者均效果显著,支持心肾获益多支柱药物联合治疗DKD的价值与可行性。研究还提示,非奈利酮联合方案可通过改善炎症反应来延缓肾脏疾病的进展。本研究尚存在单中心、样本量小、缺乏随机对照等局限,未来需开展更大样本量、更长随访的随机对照试验,以进一步评估非奈利酮对DKD的治疗效果,并不断总结非奈利酮在临床实践中的个体化治疗经验,实现DKD患者的最大获益。
参考文献:
[1] Song J, et al. Effect of finerenone on urinary protein and inflammatory factor levels in type 2 diabetes mellitus patients with diabetic kidney disease. PLoS One. 2025 Aug 18;20(8):e0329965.
[2] Agarwal R, et al. Cardiovascular and kidney outcomes with finerenone in patients with type 2 diabetes and chronic kidney disease: the FIDELITY pooled analysis. Eur Heart J. 2022 Feb 10;43(6):474-484.
[3] Agarwal R, et al. Finerenone with Empagliflozin in Chronic Kidney Disease and Type 2 Diabetes. N Engl J Med. 2025 Aug 7;393(6):533-543.
[4] Zhou J, et al. Effectiveness and safety of finerenone in diabetic kidney disease patients: a real-world observational study from China. Ren Fail. 2024 Dec;46(2):2400541.
2 comments










 京公网安备 11010502033361号
京公网安备 11010502033361号
发布留言