编者按:临床研究中的基线特征是重要的研究结果之一,有研究发现HbA1c基线特征对心脏病患者的心血管事件具有一定的预测价值[1]。那么对于2型糖尿病患者而言,是否也能通过相关的基线特征,预测患者的疗效和预后情况?今年中华医学会糖尿病学分会(CDS)大会公布了多项最新研究成果,其中关于葡萄糖依赖性促胰岛素多肽/胰高血糖素样肽1双受体激动剂(GIP/GLP-1RA)在2型糖尿病患者中临床研究的基线特征研究同样备受关注,研究结果表明[2-4],通过β细胞功能、年龄、糖尿病病程、HbA1c等基线特征可以提前获悉患者的降糖、减重等代谢获益情况。《国际糖尿病》特邀北京大学人民医院纪立农教授为我们深度分享这一前沿进展!
机制独特 Tirzepatide可带来多重获益
随着肥胖人群的增加,糖胖病的比例也明显增加。中国3B研究发现,约有60%的2型糖尿病患者属于肥胖或超重(依据中国体质指数标准)[5]。这类糖尿病患者不仅血糖控制不佳,而且还可能伴有与体重增加相关的血压、血脂异常和脂肪肝等问题,并且发生心脑血管疾病和肿瘤的风险也明显增加[5,6]。所以针对具有糖胖病的2型糖尿病患者,一方面要让血糖长期达标,控制微血管等并发症风险[7];另一方面也要降低体重,以减少肥胖和超重相关的临床不良事件[7]。现在已经出现了能够同时降糖减重的新型靶向药物(如GLP-1受体激动剂或GIP/GLP-1双受体激动剂),也获得了2024版美国糖尿病指南推荐[8]。今年美国糖尿病学会(ADA)、欧洲糖尿病研究协会(EASD)、中华医学会糖尿病学分会(CDS)等国内外顶级会议均报道了GIP/GLP-1双受体激动剂的最新研究进展。那么这类药物有何特点,从而受到广泛关注?
从机制方面而言,Tirzepatide能够同时激动GIP和GLP-1两种天然肠促胰素受体,通过两者机制的协同互补实现聚力效应[9],从而改善β细胞对葡萄糖的敏感性[10],促进胰岛素分泌,同时能够抑制胰高血糖素分泌,更强地发挥肠促胰素效应[11]。Tirzepatide还能改善脂肪组织功能并潜在减少异位脂肪沉积,因而也能改善全身胰岛素敏感性及血脂情况[12]。此外,Tirzepatide还可能作用于中枢神经系统[13]以调节机体的能量代谢。
从临床获益来看,既往SURPASS系列III期临床试验(SURPASS1-5)结果证实[14-18],3个剂量的Tirzepatide(5 mg,10 mg,15 mg)在糖化血红蛋白(HbA1c)和体重方面的降幅均优于对照组。Tirzepatide还进行了以中国人群为主的SURPASS-AP-Combo研究[19],结果表明,第40周Tirzepatide组受试者的HbA1c较基线降低2.24%~2.49%,显著优于甘精胰岛素组(降低0.95%);而且第40周Tirzepatide组患者的体重较基线可降低5.0 kg~7.2 kg,但甘精胰岛素组体重却增加1.5 kg。研究中各组未报告严重低血糖事件,总体安全性和耐受性良好。总之,相对于安慰剂或对照组(司美格鲁肽/德谷胰岛素/甘精胰岛素)[14-19],Tirzepatide在2型糖尿病(T2D)中均可显著降低HbA1c及体重,同样也能为中国人群带来获益。
了解基线特征 提前洞悉患者未来获益
上述多项研究表明,Tirzepatide可为患者带来多重临床获益。那么在患者开始治疗时,是否能够通过相关数据(如基线特征等),提前预测患者的具体疗效呢?对于不同基线特征的患者,具体疗效又是否存在差异呢?今年有多项研究对如SURPASS-AP-Combo、SURPASS-1和SURPASS-2研究进行了事后分析,部分在CDS年会上公布了相关结果,发现部分基线特征或许能够预测患者疗效情况。
一项针对SURPASS-1和SURPASS-2研究的事后分析,根据患者基线β细胞功能(HOMA2-B)和胰岛素抵抗(HOMA2-IR)的四分位数,按从低到高分为4组[4]。结果表明,在SURPASS-2中,基线β细胞功能最低分位组实现HbA1c<6.5%的可能性显著降低(图1);基线β细胞功能最高分位组的患者实现HbA1c<6.5%的可能性显著更高,并且该组更有可能实现体重降低≥15%(图2)。因而表明基线HOMA2-B具有疗效预测作用,HOMA2-B四分位数最高分位的患者可能疗效更优。
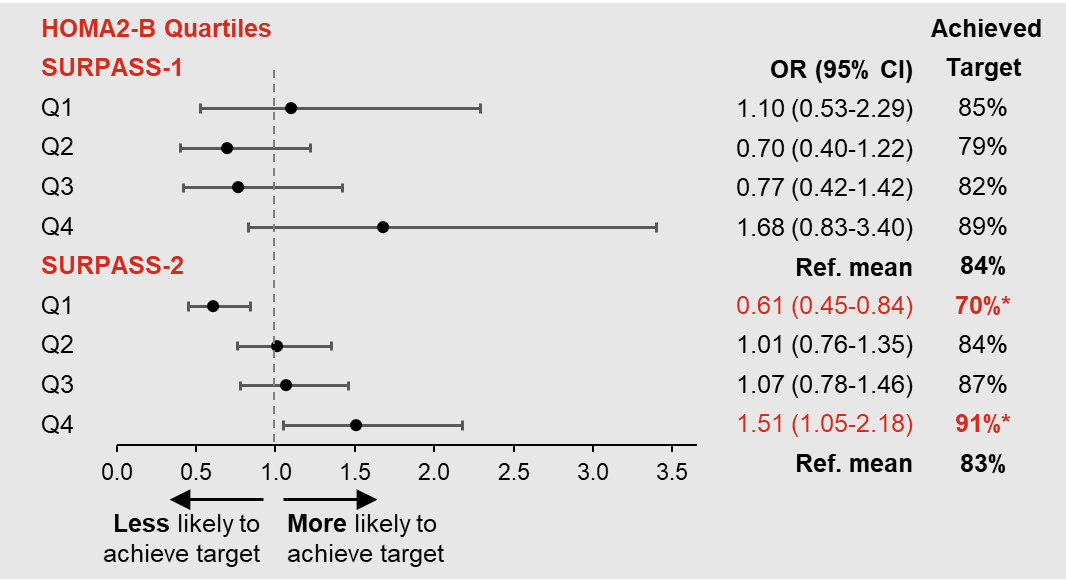

图2. 基线不同HOMA2-B四分位组别患者在第40周达到体重降低≥15%的分析(OR=优势比;Q1=第一个四分位数;Q2=第二个四分位数;Q3=第三个四分位数;Q4=第四个四分位数)[4]
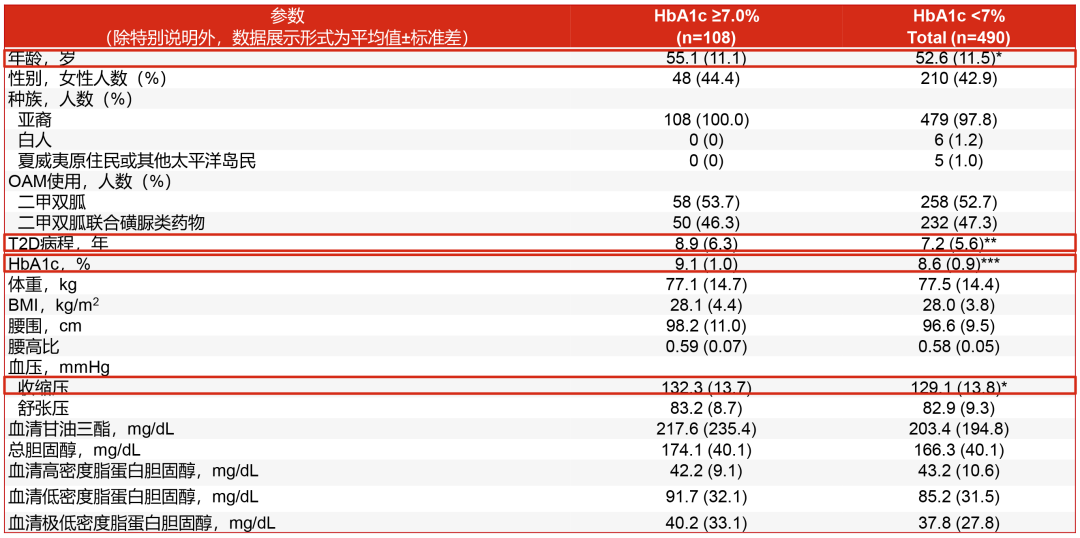
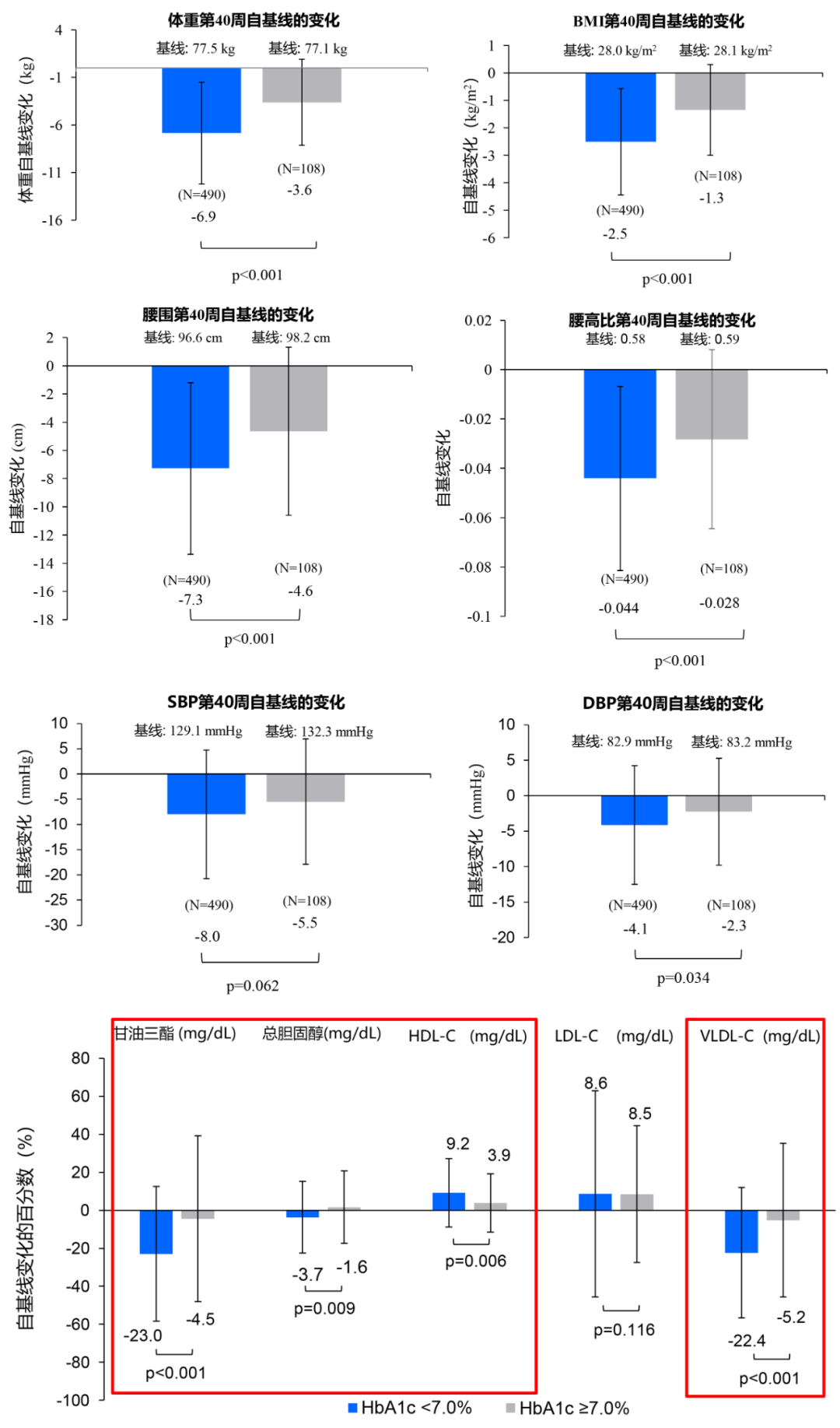
在今年CDS年会期间公布的一项SURPASS-AP-Combo研究的事后分析,探索了经Tirzepatide治疗的T2D患者中,第40周时达到不同血糖控制水平(HbA1c≥7.0%与HbA1c<7.0%)的基线特征和从基线到40周的代谢指标变化[2]。该研究结果表明,与未达标人群相比,达标人群的年龄更小、T2D病程更短、基线HbA1c更低、基线收缩压更低(图3)。进一步分析发现,达标人群(HbA1c<7.0%)的HbA1c(图4)、体重、BMI、腰围、腰高比、收缩压、舒张压等代谢指标较基线的降幅更大,并且甘油三酯、总胆固醇、高密度脂蛋白胆固醇(HDL-C)和极低密度脂蛋白胆固醇(VLDL)等脂质参数也显示出更大的改善(图5)。所以在接受Tirzepatide治疗的T2D患者中,年龄相对较轻、T2D病程相对较短、基线HbA1c水平及血压相对较低的患者可能更容易达到血糖控制目标(HbA1c<7.0%),从而也可以更好地实现其他代谢相关指标(体重、腰围、血压血脂等)的改善。

此外,CDS公布的另一项SURPASS-AP-Combo试验的事后分析则进一步探索了与HbA1c及体重降幅相关的基线特征,结果表明[3],Tirzepatide三个剂量组(5 mg、10 mg、15 mg)中,相较于基线HbA1c<8.5%组,基线HbA1c≥8.5%组患者在第40周时的HbA1c降幅更大(图6);而相较于基线体重<75 kg组,基线体重≥75 kg组患者在第40周时的体重降幅更大(图7)。
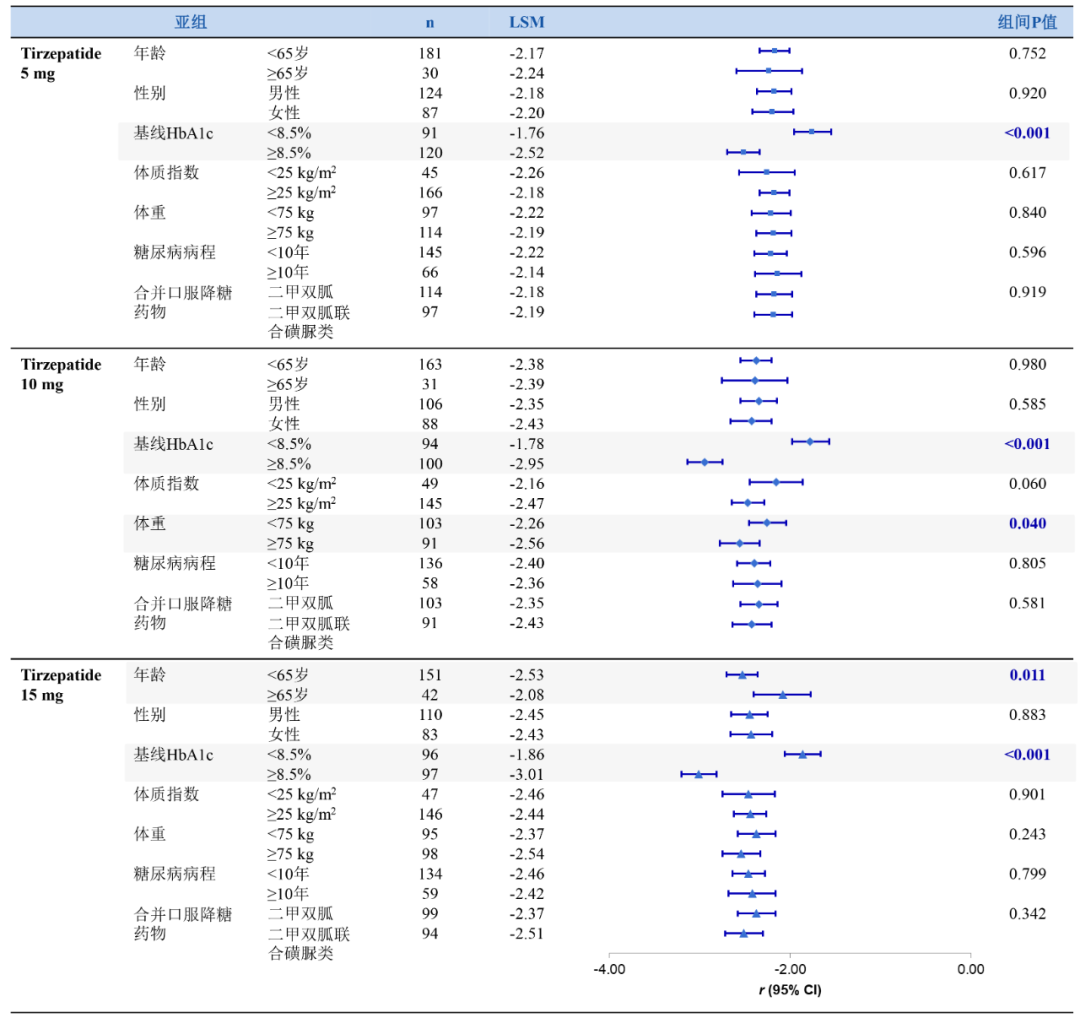

从本次CDS大会的事后分析研究结果来看,无论患者年龄(<65岁或≥65岁)、性别、基线HbA1c(<8.5%或≥8.5%)、体质指数(<25kg/m2或≥25 kg/m2)、体重(<75 kg或≥75 kg)、糖尿病病程(<10年或≥10年)以及合并口服降糖药物等[2,3]的基线水平如何,Tirzepatide均能有效降糖减重。同时,部分基线特征(比如HOMA2-B、年龄、糖尿病病程、基线HbA1c水平等)或可预测患者血糖达标或降糖减重疗效情况[2-4]。
未来可期 中国T2D患者将有更多获益
对于临床医生而言,临床工作中需要能够同时显著改善血糖和降低体重的药物,纪立农教授表示这也是目前2型糖尿病治疗中未被满足的需求。大型临床试验已证实,Tirzepatide不仅能让血糖达标,还能够有效减重、改善代谢且降低并发症风险,改善患者的生活质量,为临床医生提供了一种全新的“治疗武器”。在临床实践中,对于有年龄较轻、糖尿病病史较短、基线β细胞功能较好等基线特点的2型糖尿病患者,Tirzepatide治疗后可能使患者的HbA1c更容易达标,同时也能更显著地改善体重、腰围、血压、血脂等代谢指标,临床医生可以通过这些特点提前预测患者的疗效和获益,也为实现更好的治疗效果打下了坚实的基础。
纪立农教授指出对于2型糖尿病患者,由于既往治疗药物有限,血糖和减重的疗效不能令人满意,Tirzepatide作为一个新型的药物,可以实现更大幅度的降糖和减重,同时也可能对远期临床结局(如心脑血管疾病、脂肪肝和睡眠障碍等其他疾病)有所改善[20-22],为患者带来新的希望。此外,有上述基线特点的患者,能够从Tirzepatide治疗中获得更好的血糖达标和体重降幅,从而能够更好地改善代谢指标和降低心血管风险等。期待Tirzepatide能够尽早在中国上市,为中国2型糖尿病患者提供一个新的有效治疗手段,使更多患者获益。
参考文献:略
声明:本文仅供医疗卫生专业人士了解最新医药资讯参考使用,不代表本平台观点。该等信息不能以任何方式取代专业的医疗指导,也不应被视为诊疗建议,如果该信息被用于资讯以外的目的,本站及作者不承担相关责任。
2 comments









 京公网安备 11010502033361号
京公网安备 11010502033361号
发布留言