

教授、一级主任医师,博士研究生导师。北京市糖尿病研究所创始人兼首任所长,现任首都医科大学附属北京同仁医院内分泌学科带头人,首都医学科学创新中心临床联合研究员。
2019年入选“北京学者”。北京市战略科学家。享受国务院特殊津贴专家。
2021-2025年连续入选全球前2%顶尖科学家。
十三五国家重点研发计划首席科学家。
北京市第十三、十四、十五届人大代表。民盟中央委员。
重点开展代谢性疾病新药靶点发现与新药研发;糖尿病微血管并发症临床研究;胰岛功能基础研究。
获国家新药证书3项;以第一完成人获中华医学科技奖、教育部科技奖等省部级科技奖6项。主持国家自然科学基金重点项目、国际合作、专项及面上项目9项。以第一/末位通讯作者在STTT (2篇)(IF:52.7) 、Diabetes Care (6篇) (IF:16.6)、Nature Commm (IF:15.7)、Cell Discovery (IF:12.5) 等期刊发表SCI论文120余篇,他引超过12000次。获授权中国发明专利7项,美国发明专利1项。
一、抗疟老药的新角色与争议
疟疾与糖尿病,两种看似无关的疾病,却因抗疟药而产生了奇妙的联系。自17世纪奎宁用于治疗疟疾以来,临床就观察到部分患者出现难以解释的低血糖。后续的研究认为,这与奎宁直接刺激胰腺β细胞分泌胰岛素有关,其机制为奎宁通过抑制了胰岛β细胞膜上的ATP敏感钾通道(KATP),导致细胞去极化、钙离子内流,从而触发胰岛素释放。
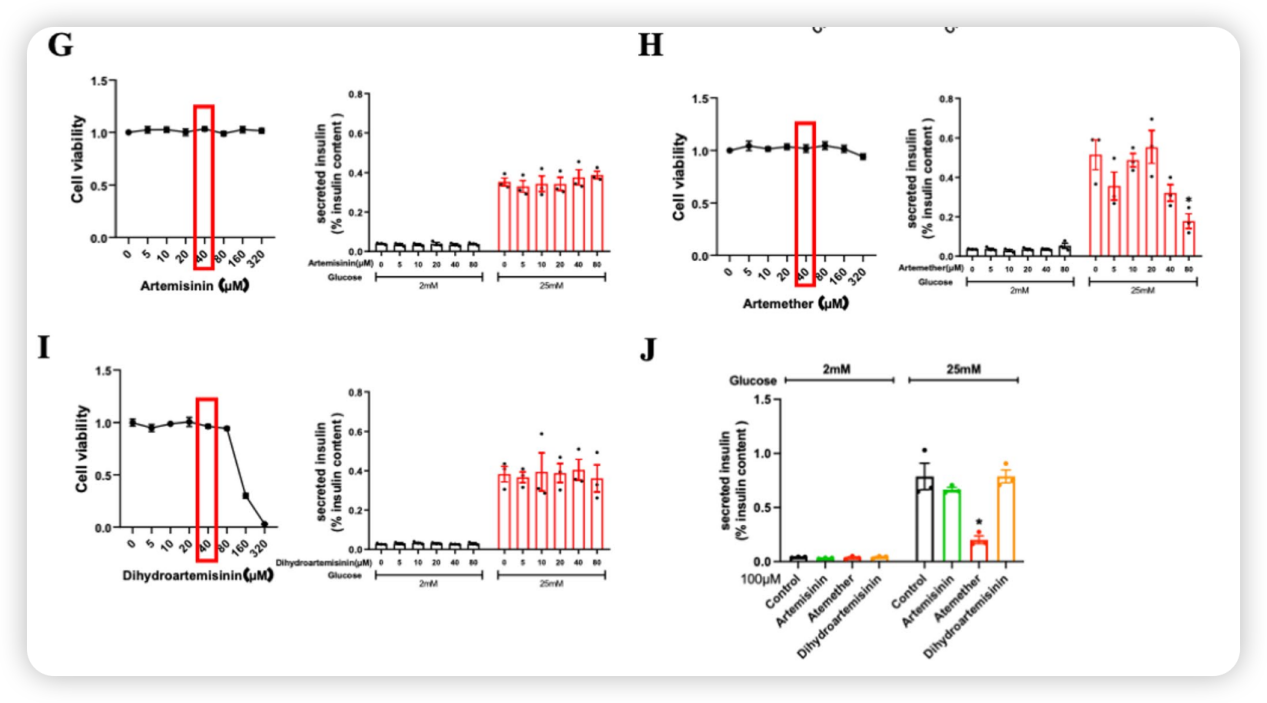
2017年,一项发表于Cell的里程碑研究提出,青蒿素可通过靶向GABA受体信号通路,促进胰腺α细胞转化为具备胰岛素分泌功能的β细胞。这一发现为1型糖尿病的细胞再生治疗带来了巨大希望,也迅速将青蒿素及其衍生物(如蒿甲醚、双氢青蒿素)推向糖尿病研究的前沿。然而,该突破性结论随后引发了持续的科学争议。多项后续独立研究在不同实验体系中未能重复出青蒿素促进α细胞向β细胞转化的结果,部分研究甚至观察到相反或无效的效应。因此目前青蒿素对胰岛素分泌的作用存在巨大争议。
杨金奎教授团队长期深耕胰岛素分泌失调机制。他们发现 KCNH6钾通道在胰岛β细胞的复极化过程中扮演关键角色,其功能异常可导致胰岛素分泌失调。因此,他们产生了一个大胆的假设:这些广泛使用的抗疟药会通过作用于KCNH6钾通道,从而影响胰岛素的分泌吗?
为了验证这个假设,杨金奎教授团队设计了系列严谨的体外与体内实验,对三类代表性喹啉药(奎宁、奎尼丁、氯喹)和三类青蒿素衍生物(青蒿素、蒿甲醚、双氢青蒿素)进行了系统性“头对头”比较。
二、核心发现:奎宁与蒿甲醚的“促抑对决”
01. 是促还是抑?截然不同的胰岛分泌曲线
研究首先在离体小鼠胰岛上检验了六种药物直接的葡萄糖刺激胰岛素分泌(GSIS)效应。结果显示:
喹啉类呈现复杂的促胰岛素分泌效应
在高糖环境下,奎宁和奎尼丁均显示出剂量依赖性的促胰岛素分泌作用。值得注意的是,高浓度(40 μM)的奎宁在没有葡萄糖刺激的情况也能引发胰岛素释放。而氯喹则呈现双相作用:低浓度(5 μM)时抑制了胰岛素分泌,高浓度时转为促进作用。
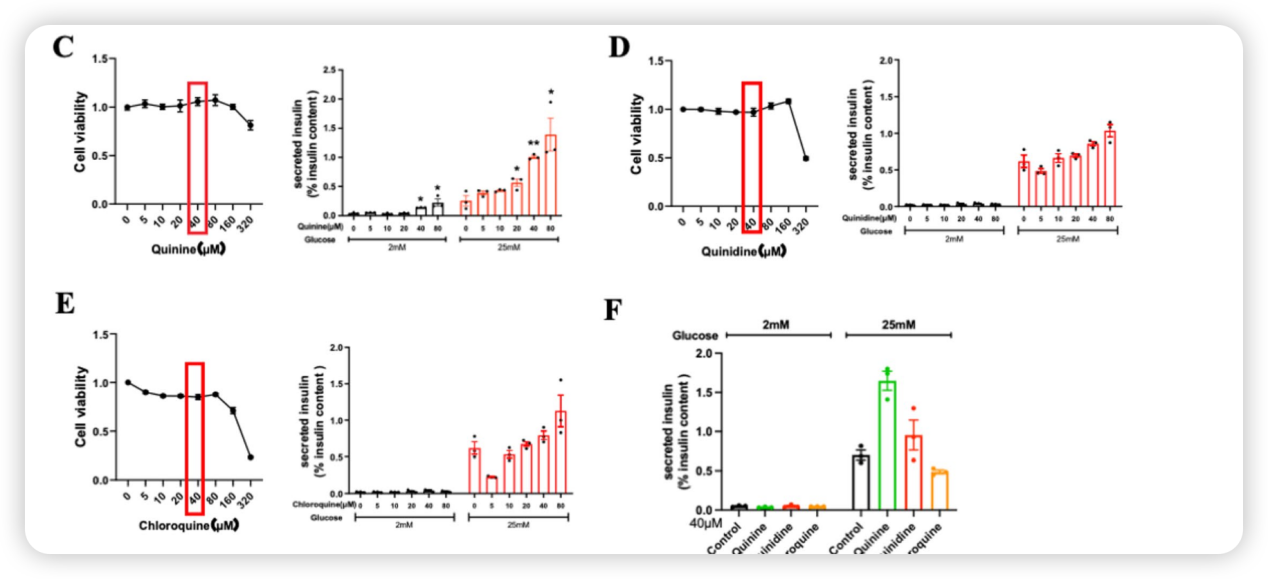
青蒿素和双氢青蒿素在测试浓度范围内对胰岛素分泌影响微弱,而蒿甲醚则表现出明确的抑制作用,当浓度超过40 μM时,显著降低了高糖刺激下的胰岛素分泌。随着浓度升至100 μM,只有蒿甲醚显著抑制胰岛素分泌。
02. 胞内钙信号:胰岛素分泌的重要佐证
鉴于胞质Ca离子与胰岛素分泌紧密相关,研究者评估了施用喹啉类或青蒿素类后细胞内Ca离子水平。
奎宁能有效引发明显的钙离子尖峰,尤其在低糖条件下亦如此,印证了其强大的膜去极化能力。
奎尼丁和氯喹也能提升钙离子浓度,但幅度小于奎宁,这与其相对较弱的促胰岛素分泌效应相符。
蒿甲醚和双氢青蒿素显著削弱了高葡萄糖诱导的钙离子浓度上升,青蒿素无明显影响。进一步研究发现,蒿甲醚还能抑制由氯化钾引发的钙内流和胰岛素分泌,提示其抑制作用发生在共同的下游通路。
Ca离子监测的结果再次印证了奎宁与青蒿素类对胰岛素分泌的不同作用。
03. 靶点锁定:KCNH6通道是关键差异所在
为何两类药物效应迥异?KCNH6通道是否是差异的关键所在?膜片钳实验提供了分子层面的关键证据。
喹啉类是高效的KCNH6抑制剂: 三种喹啉类药物均能强力、即时地阻断KCNH6钾通道电流,其半数抑制浓度(IC50)在亚微摩尔到微摩尔级别(奎宁 2.123 μM, 奎尼丁 0.8725 μM, 氯喹 3.610 μM),显示出很高的亲和力。
与之相反的是,青蒿素衍生物对KCNH6的阻断作用非常微弱,IC50值高出喹啉类数十至数百倍(青蒿素 113.8 μM, 蒿甲醚 92.65 μM, 双氢青蒿素 >400 μM)。
因此,两类药物对KCNH6通道的不同作用可能是差异的关键所在。
04. 动物实验验证:奎宁作用依赖KCNH6,蒿甲醚长期效应存疑
本研究通过动物实验进一步证实了两种药物作用的差异特征。
在动物实验中,高剂量奎宁腹腔注射能直接降低小鼠血糖并促进胰岛素分泌。而更具机制验证意义的是,在KCNH6基因β细胞特异性敲除小鼠模型中,低剂量奎宁在野生型小鼠中表现出的"增强葡萄糖刺激胰岛素分泌"效应完全消失,这一结果直接证实了KCNH6通道是奎宁发挥促胰岛素作用的关键体内靶点。
相比之下,蒿甲醚在体内实验中并未表现出明显的胰岛素抑制效应。连续20天口服给药(20 mg/kg/天)的小鼠,其体重、葡萄糖耐量和体内胰岛素分泌水平均无显著变化。然而,在体外实验中,蒿甲醚短期处理能强烈抑制胰岛功能,长期(72小时)处理也明确降低了胰岛对葡萄糖和KCl的胰岛素分泌反应。对于这种体内外表现的差异,研究者认为可能与体内复杂的药物代谢、组织分布特性以及潜在的生理代偿机制有关。
05. 基因表达谱:蒿甲醚抑制β细胞功能标志物
为了深入探索蒿甲醚抑制胰岛素分泌的机制,研究团队对经蒿甲醚长期处理的胰岛进行了RNA测序分析,结果发现:
多个重要的β细胞功能与身份维持基因,如胰岛素基因(Ins1, Ins2)、β细胞成熟标志物(Ucn3)、葡萄糖转运蛋白2(Slc2a2)以及关键转录因子(Pdx1, Mafa)的表达均显著下调。
“胰岛素分泌”的信号通路受到影响,同时,α细胞特征基因(如Arx, Irx1)和胰高血糖素蛋白表达也下降。
这些分子层面的发现与“青蒿素促进α细胞向β细胞转分化”的假说预期完全相反。研究没有观察到α细胞获得β细胞特征,而是发现β细胞自身功能标志物的减弱,提示“去分化”或功能抑制状态的可能。蛋白质水平和免疫荧光染色结果进一步证实了胰岛素表达的降低。
三、研究的核心成果及意义
本研究证实了两种经典抗疟药对胰岛素分泌的相反作用,并揭示了重要的潜在作用靶点。一方面,研究确认奎宁在更接近生理的低剂量下,其增强葡萄糖依赖的胰岛素分泌主要是通过抑制KCNH6钾通道实现的。KCNH6如同β细胞电活动的“调速器”,其被抑制后能延长钙离子内流,从而放大葡萄糖信号,这一发现不仅解释了奎宁引起低血糖的精细机制,更将KCNH6确立为开发新一代胰岛素促分泌剂的崭新靶点。另一方面,研究对青蒿素类药物的“促胰岛再生”假说提出挑战。在小鼠模型中,蒿甲醚并未表现出促进胰岛素分泌或诱导α细胞转分化的能力,反而在体外抑制胰岛素分泌并下调β细胞功能基因,这一结果为相关科学争议提供了重要的反面证据,提示其在糖尿病治疗中的应用需格外审慎,其对胰岛素的作用需要在不同模型,尤其是人类系统中,进一步验证。
这项研究的价值,远不止于厘清两种药物的具体作用。它以系统、可重复的实验证据,挑战了此前有关青蒿素能促进胰岛再生的存疑假说,同时深化了对奎宁这类老药促胰岛素分泌作用机制的理解,凸显了在“老药新用”探索中严谨基础研究的关键性。更重要的是,研究证实了KCNH6在奎宁的促胰岛素过程中的作用,因此是降糖治疗潜在的治疗靶点,可能成为更精准、副作用更小糖尿病疗法的新路径。这充分展现了基础研究是如何为攻克宏观临床难题提供坚实的科学基石与创新源泉。
总之,这项研究如同一次精密的“药理画像”,不仅清晰描绘了奎宁与青蒿素对胰岛功能的“阴阳”两面,更在此过程中,为战胜糖尿病找到了一个充满希望的未来新方向。
参考文献:1.Lu, J., Xiong, F., Zhang, Q., Zhao, R., Zhang, C., Wei, G., & Yang, J. (2025). The contrasting effects of two antimalarial drugs on insulin secretion. Cellular and molecular life sciences : CMLS, 82(1), 419. https://doi.org/10.1007/s00018-025-05933-0
2 comments










 京公网安备 11010502033361号
京公网安备 11010502033361号
发布留言