概要:流行病学调查表明,高原地区(海拔1500~3500米)的2型糖尿病(T2DM)发病率明显低于平原地区(海拔<500米),但潜在机制尚不明确。由广东省人民医院急诊科李欣教授团队牵头中山大学孙逸仙纪念医院内分泌科刘丹教授团队、中山大学孙逸仙纪念医院医学研究中心陈思凡研究员团队、林芝市人民医院王玉娥主任团队、上海百趣代谢组学技术研究中心刘志鹏研究员团队的多团队联合合作[1]发现,中等海拔暴露可能介导人体血糖稳态调控,对人群高原暴露前后进行肠道菌群-血清代谢物-血糖代谢研究表明,鸟枪宏基因组测序评估发现中等海拔高原暴露前后肠道菌群组成改变,非靶向代谢组学则显示中等海拔暴露的个体表现出较低的空腹血糖(FBG),该变化趋势与血清丙酸、L-谷氨酸和L-缬氨酸变化呈正相关,与L-谷氨酰胺呈负相关,并与粪便Bacteroidetes门丰度负相关和Proteobacteria门丰度正相关。另外,中介分析显示肠道菌群、血清代谢组和宿主FBG之间的相互关系:L-谷氨酸能介导Bacteroides ovatus(B. ovatus)和FBG间的负作用,L-谷氨酸和L-缬氨酸能介导Escherichia coli(E. coli)和FBG间的正作用。此外,团队采用中等海拔高原暴露后人群粪便对高脂饮食(HFD)小鼠进行菌群移植,结果表明可降低小鼠的FBG、L-谷氨酸和胰岛素抵抗指数(HOMA-IR),以及粪便中Firmicutes/Bacteroidetes的比例。这进一步验证了菌群在中等海拔高原暴露调节血糖代谢中有重要的因果作用,可能是通过降低L-谷氨酸、L-缬氨酸和增加L-谷氨酰胺水平等的血清代谢变化实现的。
本研究结果表明,中等海拔暴露可能通过调控肠道菌群和血清代谢组维持血糖调控稳态,可能是防治血糖代谢失衡的新靶点和新途径。

论文下载网址
https://www.sciencedirect.com/science/article/pii/S0048969723056413
研究背景
糖尿病是最主要的慢性代谢性疾病之一。目前全球约有5.37亿人患有糖尿病,其中超过90%为T2DM患者[2]。糖尿病病程发展中的并发症,如糖尿病肾病、动脉粥样硬化等,均具有相当高的发病率和死亡率。然而,目前仍缺乏糖尿病及其并发症的有效预防手段。
既往研究提示,高海拔环境与糖尿病及相关代谢性疾病的发生发展具有相关性[3],但高海拔对人体的利弊效应仍存在高度争议。根据国际山地医学学会(www.ismmed.org)推荐的分类,高于海平面1500~3500米以上的区域定义为高海拔,其中1500~3000米的区域被细化分为中等海拔。自然状态下,高海拔环境以低气压、低氧分压和强紫外线辐射为特征。长期居住在高海拔(3500~5500米)或极高海拔(5500米以上)地区可能会导致高原疾病。高海拔暴露可能和机体炎症、患病和感染风险及急性山地病(AMS)具有相关性。海拔变化对人体内稳态平衡的影响在1500米以上开始明显,在超过3000米时变化尤为显著。值得注意的是,健康成年人在高海拔(5300米)区域短期徒步旅行(11天)时,即出现血糖水平下降,甚至发生低血糖;但在极高海拔(5895米或8201米)中,则出现AMS评分增加或机体代谢水平恶化。
机体可通过增强换气、加快心率和提高血红蛋白浓度等方式来适应高海拔的极端条件。目前已有多项研究表明,海拔高度与糖尿病、肥胖的发生率间存在负相关关系,并且中等海拔暴露和适度缺氧对人体生理存在有利影响。例如,中等海拔暴露对游客或前往训练的运动员具有提高心肺功能、减轻体重、改善FBG的作用。此外,在高海拔区域短期居住(3天~7周)或间歇性低氧暴露可维持人体或小鼠的血糖调控稳态。流行病学调查报告也表明,高原地区(1500~3500米)的T2DM发病率明显低于平原地区(<500米)。种种证据均提示,适度海拔暴露的低压、低氧环境可能对机体血糖稳态产生有益影响。然而,海拔暴露对糖尿病及其相关代谢功能障碍的确切作用和基本机制仍然未知。
大量研究表明,胰岛素抵抗和罹患T2DM可能与肠道微生态失调相关。生活干预(如运动、饮食、药物、胃肠分流手术)和粪菌移植(FMT)可通过调节肠道微生态,影响代谢物[如短链脂肪酸、支链氨基酸(BCAAs)、芳香族氨基酸(AAAs)、胆汁酸]的合成和分解,从而改善代谢综合征和T2DM患者的血糖调控稳态和胰岛素敏感性。高海拔暴露改变肠道微生态,从而影响人或其他动物(如小鼠、牦牛)的表型特征。然而,先前研究普遍应用16S扩增子测序而非鸟枪宏基因组测序技术,且主要集中为海拔>3000米的短期(1天~1个月或1个月~3个月)暴露,长期(12个月~)中等海拔暴露对特定肠道微生物群的影响及对血糖稳态的功能作用仍鲜为人知。
因此,本研究招募来自广州市(平均海拔<50米)的健康志愿者(A队列,49例),评估其进入西藏林芝市(平均海拔2900米)居住12个月后的血糖稳态和血清代谢物变化;并采用独立验证队列B队列:来自广州市并在林芝市居住12个月的47例健康志愿者(汉族,第1组),以及在林芝市居住5年以上的健康志愿者(汉族:藏族=36:11,第2组),对研究结果进行进一步验证。合作团队分析中等海拔暴露对血糖代谢、肠道微生态和血清代谢物的影响;并分析中等海拔暴露影响的肠道菌群,是否能通过血清代谢物调控血糖代谢。最后,通过将中等海拔暴露12个月的人群粪便移植到高脂饮食(HFD)小鼠体内,进一步因果验证中等海拔暴露是通过调控肠道微生态来影响血糖代谢的(图1)。
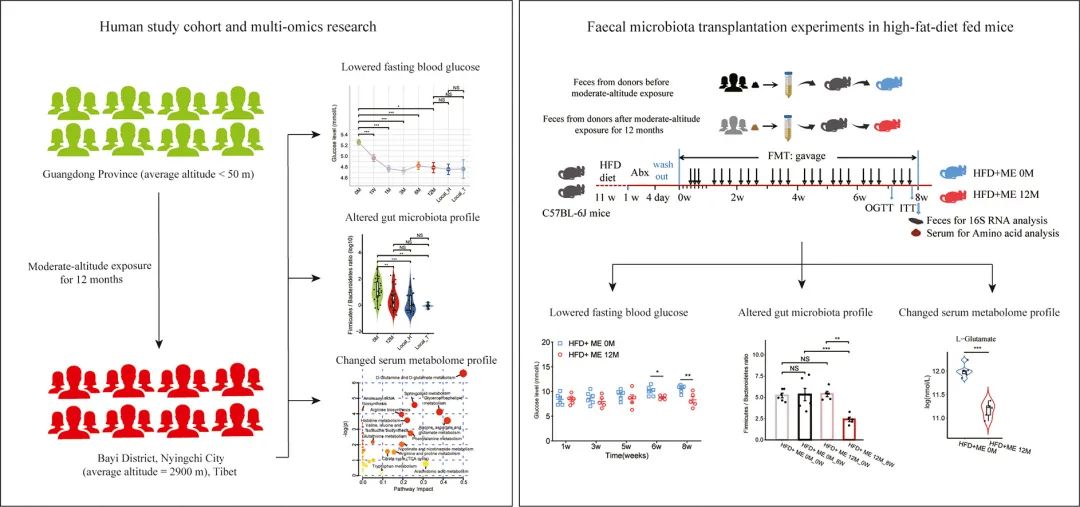
图1. 研究内容要点
研究结果
01 中度海拔暴露对研究参与者临床指标的影响
采集多个时间节点的临床指标数据,可更好地评估中等海拔暴露对机体的影响。所有参与者在驻藏期间均无新发疾病、合并感染和胃肠道疾病等。在采集的16个临床指标中,有11个在两个队列中均表现出相同的变化趋势。其中,体重、体重指数(BMI)、收缩压、FBG、低密度脂蛋白等7个临床指标在入藏后下降,心率和脂联素等4个临床指标在入藏后增加,且所有临床指标变化均在正常阈值内(图2A)。
糖尿病以血糖水平升高为主要临床表现。LME模型提示,队列A和队列B的FBG均出现显著降低(图2B),且极大程度上依赖于中等海拔暴露的时间(校正P<0.05);进一步校正瘦素、脂联素、体重和BMI等因素后,两个队列中的FBG仍显著降低(P分别为7.45E-13和5.70E-04)。
此外,合作团队对B队列的汉族参与者进行入藏前后饮食习惯和体力活动的抽样调查,发现参与者的膳食营养素(包含总能量摄入、碳水化合物、脂肪、蛋白质)摄入量在入藏前后保持不变(P>0.05);同时,入藏后志愿者的活动强度降低。先前研究已报道,高强度体力活动可降低血糖并改善代谢稳态。而合作团队发现,中等海拔暴露过程中,志愿者饮食因素无明显变化、活动量减低,仍出现血糖稳态改善,这表明血糖稳态改善更可能是由中等海拔暴露介导的。基于这个前提,合作团队采用B队列汉族人群高原暴露前后的指标,用于肠道菌群-血清代谢物-血糖代谢研究。
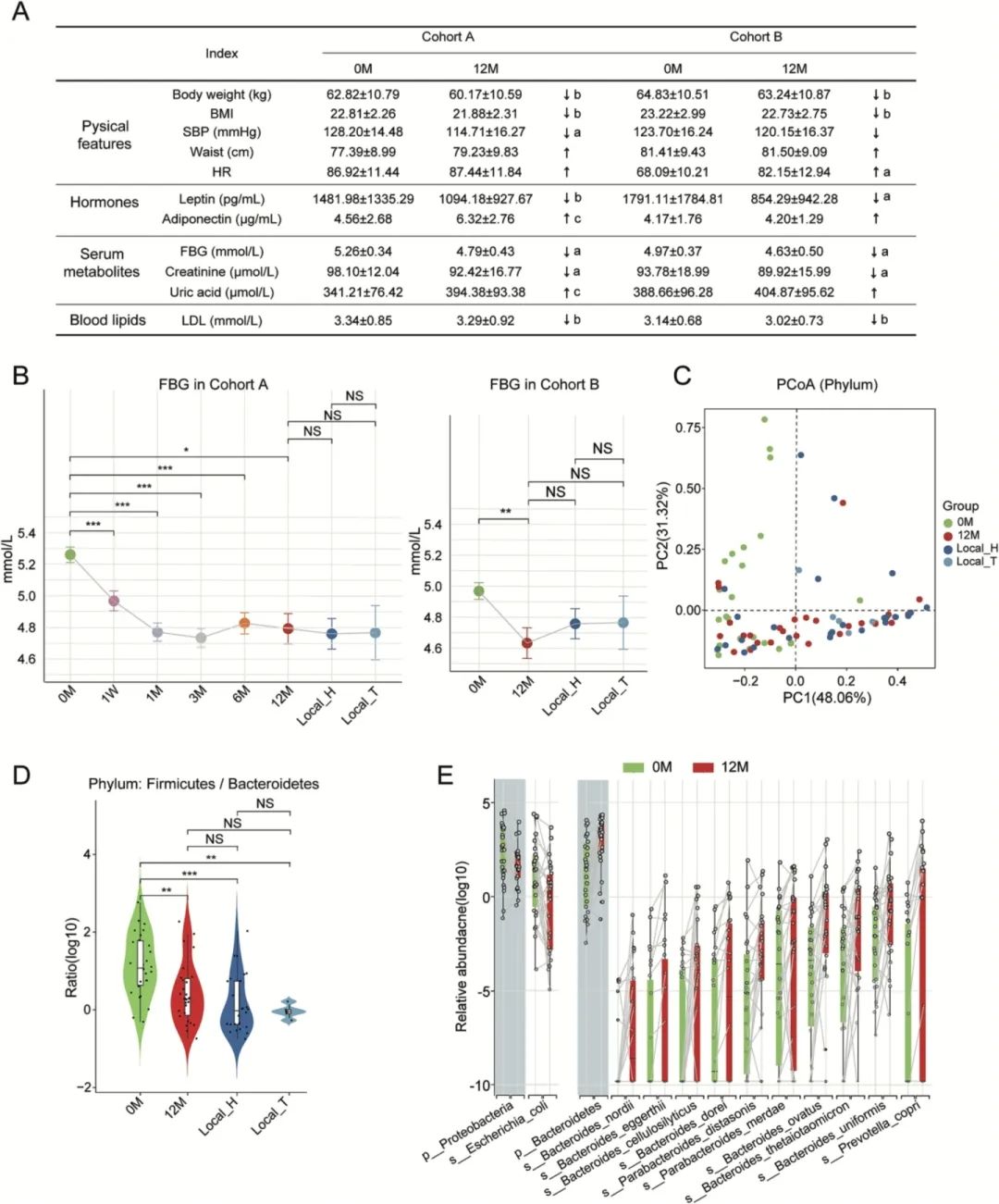
图2. 临床指标和宏基因组结果
02 中等海拔暴露对肠道菌群的影响
为进一步研究中等海拔暴露对特定肠道微生物和代谢途径的影响,合作团队对B队列的83份粪便样本进行宏基因组测序,主成分分析(PCoA)显示志愿者入藏前后肠道微生态(门、属和种水平)均出现显著变化[置换多元方差分析(PERMANOVA):P=0.002、0.007、0.01](图2C)。中等海拔暴露12个月(12M组)的肠道微生物群落丰度降低、α多样性升高;与入藏前汉族0M组相比,Firmicutes/Bacteroidetes比例显著降低(P<0.05),但与当地居民(汉族群体:Local_H组和藏族群体:Local_T组)相比无差异(图2D);入藏12个月后,Bacteroidetes相对丰度增加,Proteobacteria相对丰度减少(图2E)。在种水平上,12M组有20种菌种增加,24种菌种减少;其中,Bacteroidetes ovatus在12M组中显著增加,Actinomyces odontolyticus和candidate division_TM7_single_cell_isolate_TM7b等在12M组中显著减少(校正P<0.05)。拟杆菌属中的B. ovatus、Bacteroides thetaiotaomicron(B. thetaiotaomicron)、Bacteroides uniformis(B. uniformis)和副拟杆菌属的Parabacteroides distasonis(P. distasonis)在12M组中增加(图2E),这些菌种已被报道可减轻HFD小鼠的代谢综合征。此外,本研究还发现E. coli、Rothia mucilaginosa和A. odontolyticus等机会性病原体在12M组中减少。
总的来说,这些数据揭示,中等海拔暴露后,个体的肠道微生物群体出现明显的组成变化,表现为Bacteroidetes属增多(如B. ovatus)和Proteobacteria属减少(如E. coli)。
03 中等海拔暴露对肠道菌群功能的影响
合作团队对鉴定出的6435个KEGG Orthologs(KOs)进行差异分析,与入藏前相比,12M组肠道菌群的318个KOs增强,537个KOs减弱(校正P<0.05);40个KEGG模块显著增强和55个KEGG模块显著减弱(校正P<0.05)。此外,有56个KEGG通路在所有组之间存在显著差异:31条KEGG通路富集和25条KEGG通路减少(校正P<0.05)。其中,与L-Glutamate相关的氨基酸代谢通路(如D-glutamine和D-glutamate 代谢通路、Alanine, aspartate和glutamate代谢通路、GABAergic synapse、Glutamatergic synapse、Arginine和proline代谢通路)在12M组中显著升高,表明肠道菌群的L-Glutamate代谢可能在中等海拔暴露个体中发挥重要作用。此外,与BCAAs降解相关的KEGG模块如“Leucine degradation, leucine => acetoacetate + acetyl-CoA”、“Pantothenate biosynthesis, valine/L-aspartate => pantothenate”的相关基因丰度在12M组中显著增加,表明中等海拔暴露个体的肠道菌群可能有更高的BCAAs降解能力。
为进一步了解肠道菌群的厌氧发酵能力,通过基因注释获得GMMs(Gut Metabolic Modules),与入藏前相比,12M组的肠道菌群有14个MFs增强、11个MFs减弱(校正P<0.05),其中参与丙酸合成代谢的MF0084(Succinate conversion to propionate)、MF0093(Propionate production I)、MF0094(Propionate production II)和MF0080(Lactate consumption II)在12M组中减弱,这表明个体入藏后肠道菌群的丙酸合成能力降低。据报道丙酸水平与T2DM风险呈正相关,该结果也得到两个队列的血清丙酸靶向检测验证,且12M组的丙酸水平开始与林芝地区居住5年以上的个体变得相近(图3A、3B)。
最后,研究团队使用HUMAnN 2分析中等海拔暴露相关的微生物对MetaCyc通路的贡献度。与入藏前相比,41条PWY通路在12M组中升高(如厌氧功能gondoate合成通路PWY-7663中B. ovatus和B. thetaiotaomicron贡献度较高),92条PWY通路降低[如LPS生物合成通路LPSSYN-PWY、芳香族氨基酸合成通路(PWY-6628、PWY-6629、PWY-6630)中E. coli贡献度较高等](图3C)。与肠道菌群组成的变化类似,NMDS分析显示中等海拔暴露个体的微生物组功能与居住在林芝5年以上个体的肠道菌群功能相似。
简而言之,上述数据表明,中等海拔暴露后个体的肠道菌群可能具有更高的L-Glutamate和BCAAs降解能力、较低的丙酸和芳香族氨基酸生成能力,这些变化趋势均报道与改善胰岛素抵抗相关。
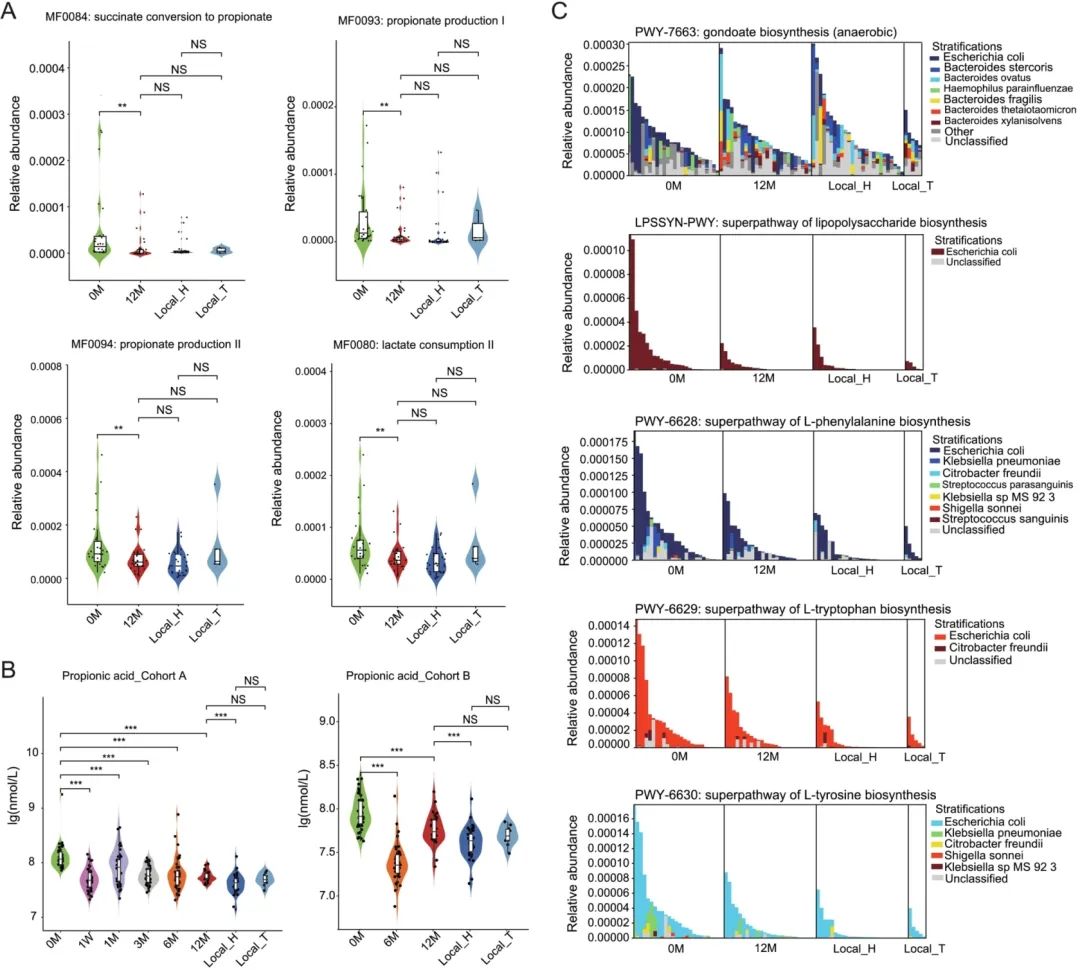
图3. 入藏前后肠道菌群功能的变化
04 中等海拔暴露对血清代谢物的影响
有研究报道,T2DM和肥胖患者的血清代谢物变化与肠道菌群改变有关。合作团队对306份血清样本进行非靶向代谢组学检测,与入藏前相比,正交偏最小二乘法判别分析(OPLS-DA)发现,中等海拔暴露后出现明显的血清代谢变化,并且在两个队列中都观察到相似的基线血清代谢谱(图4A)。团队对队列A的血清代谢数据进行线性混合模型(LME)分析,发现112种与中等海拔暴露相关的代谢物(校正P<0.05)。时间序列分析(STEM)显示有32种代谢物(如L-谷氨酸、γ-谷氨酰亮氨酸和γ-谷氨酰缬氨酸等)随中等海拔暴露时间增长而降低,15种代谢物(如L-谷氨酰胺)随中等海拔暴露时间延长而增加(图4B)。代谢通路富集分析表明,D-glutamine和D-glutamate代谢通路,以及Alanine、aspartate和glutamate代谢通路发生显著变化(图4C)。
非靶向血清代谢组学和宏基因组学分析均揭示,循环AAs的变化可能与肠道菌群功能改变有密切关系。因此,研究团队对423份血清样本进行AAs定量检测。OPLS-DA分析显示,两个队列的AAs谱均发生显著变化(图4D),且AAs随着中等海拔暴露时间的增加而发生显著变化。队列A和队列B汉族人中的18种未修饰AAs、与胰岛素抵抗相关的AAs(BCAAs和AAAs的总和)的浓度在中等海拔暴露后显著降低(图4E)。在24种检测的AAs中,与入藏前相比,入藏12个月后的血清有19种AAs减少,3种AAs增加(图4F),其中L-谷氨酸和L-缬氨酸显著降低(校正P<0.05),而L-谷氨酰胺在队列A中显著性增加(校正P=6.65E-31)。此外,中等海拔暴露个体的AAs谱与常驻林芝5年以上个体的血清AAs谱变得相似(图4D)。
综上所述,这些结果表明,与代谢紊乱相关的循环L-谷氨酸和L-缬氨酸减少,而抗炎、抗肥胖的L-谷氨酰胺在中等海拔暴露后增加。
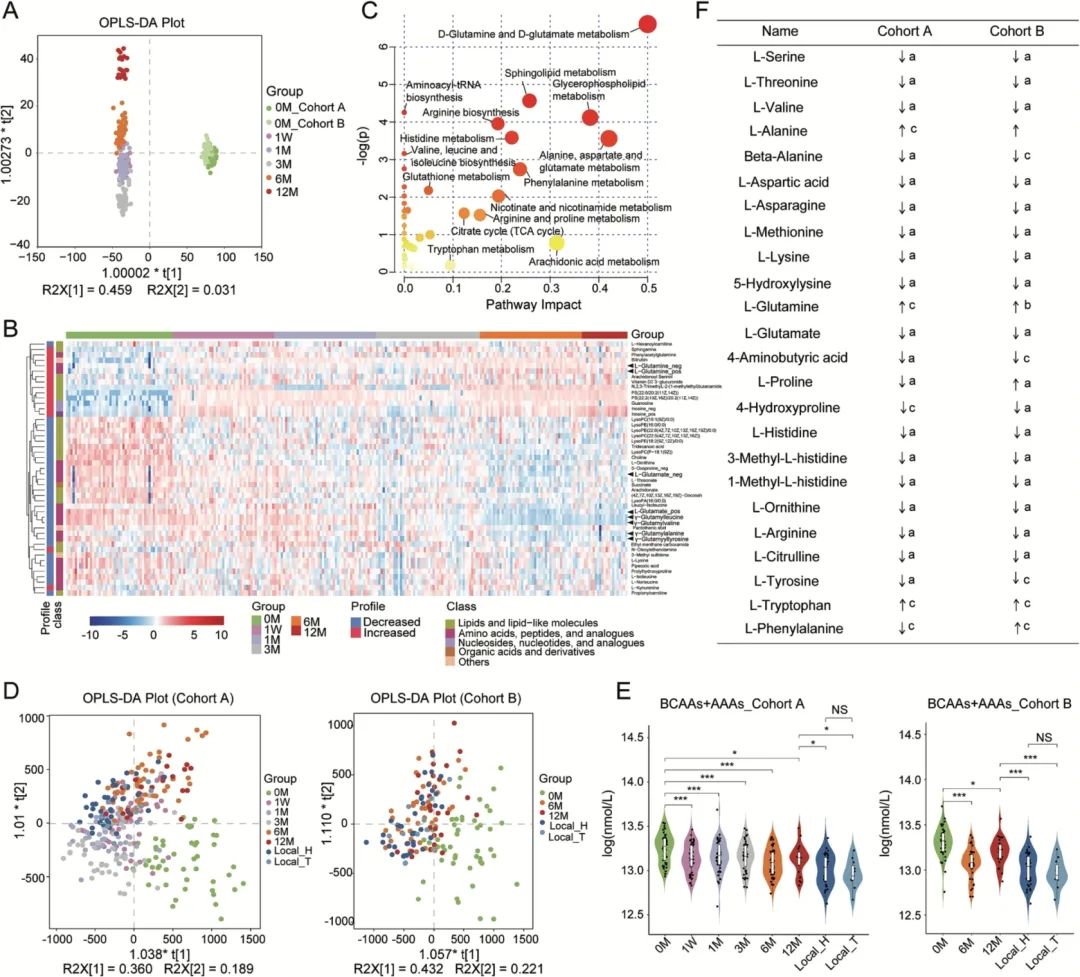
图4. 入藏前后血清非靶代谢组和氨基酸检测结果
05 肠道菌群与血清代谢物和表型的关联
为进一步明确中等海拔暴露下血清AAs和肠道微生物组之间的相关性,研究团队进行了spearman相关性分析。在门水平上,L-谷氨酸、L-缬氨酸、L-苯丙氨酸、L-酪氨酸和L-色氨酸与Bacteroidetes呈负相关,与Proteobacteria呈正相关(校正P<0.05)(图5A);种水平上,L-谷氨酰胺与B. cellulsilyticus呈正相关,L-谷氨酸与B.ovatus和B.cellulosilyticus呈负相关,L-谷氨酸、L-缬氨酸、L-苯丙氨酸、L-酪氨酸和L-色氨酸与E. coli呈正相关(校正P<0.05)(图5A)。
此外,团队使用Rmcorr方法在两个队列中分析受试者代谢物与临床指标之间的相关性,发现两个队列中L-缬氨酸和L-谷氨酸与体重和BMI呈显著正相关,FBG与L-谷氨酰胺呈显著负相关,与L-谷氨酸呈正相关(校正P<0.05)(图5B)。
为进一步探究肠道菌群对BCAAs、L-谷氨酸和L-谷氨酰胺的合成和降解能力的变化,团队选取与这些功能相应的肠道微生物KOs进行分析,发现肠道菌群的L-亮氨酸和L-异亮氨酸的合成和降解功能、L-缬氨酸的降解功能无显著性变化;而与L-缬氨酸合成相关的KO0835[缬氨酸-丙酮酸氨基转移酶(EC:2.6.1.66)]和K14260[丙氨酸合成转氨酶(EC:2.6.1.2)]降低,且这两个KOs均与Proteobacteria的丰度减少有关。与L-谷氨酸转化成L-谷氨酰胺相关的KO1915[谷氨酰胺合成酶(EC:6.3.1.2)]显著升高,而KO1915与Bacteroidetes(例如B. ovatus)的升高有关;而与L-谷氨酰胺降解相关的KOs无显著性变化。接着将这3个KOs和3种代谢产物进行了spearman相关性分析,发现L-缬氨酸和L-谷氨酸与KO1915(与丙氨酸、天冬氨酸和谷氨酸代谢相关的map00250)呈负相关,与KO0835和K14260(与缬氨酸、亮氨酸和异亮氨酸生物合成相关的map00290)呈正相关(图5C);而L-谷氨酰胺与KO1915呈非显著正相关,与KO0835和K14260呈非显著负相关。
接下来,研究团队为探讨L-缬氨酸、L-谷氨酸和L-谷氨酰胺是否可以解释或介导肠道菌群(即B. ovatus、E. coli)与临床指标(即FBG、BMI、BW)之间的关联,采用中介分析进行进一步分析。结果发现,L-谷氨酸能介导B. ovatus和FBG间的负作用(P<0.05),而L-谷氨酸和L-缬氨酸能介导E. coli和FBG间的正作用(P<0.05)(图5D);此外,L-谷氨酸和L-缬氨酸还能介导B. ovatus与BMI和BW间的负作用、E. coli与BMI和BW间的正作用(图5D)。但L-谷氨酰胺对B. ovatus和E. coli与临床指标(即FBG、BMI、BW)没有显著的中介作用。由此可知,中等海拔暴露个体中的循环L-缬氨酸和L-谷氨酸可能介导B .ovatus和E. coli对临床指标(即FBG、BMI、BW)的影响。
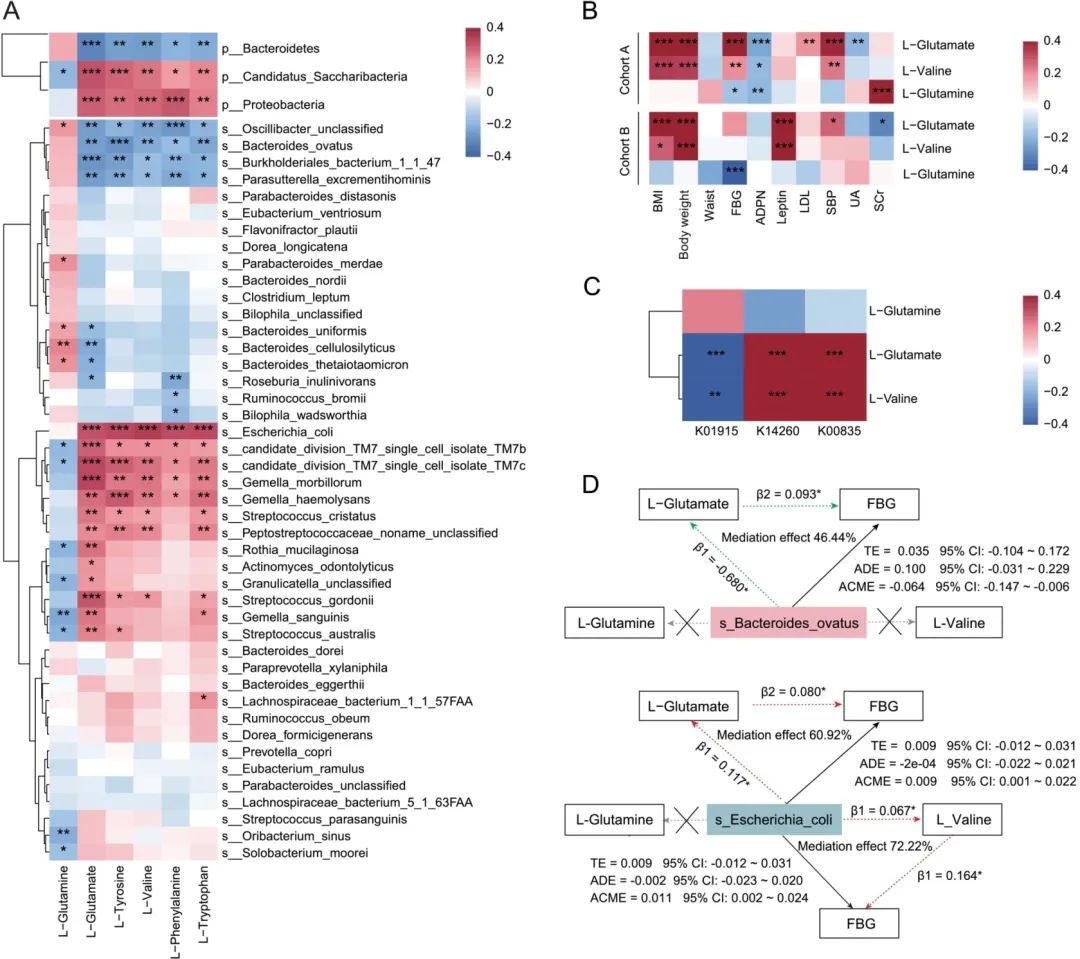
图5. 关联分析结果
06 中等海拔暴露后的粪菌移植实验改善HFD小鼠的血糖调控稳态
为进一步研究中等海拔暴露个体的肠道菌群对AAs和FBG的影响,团队随机选择6例入藏前、6例入藏12个月后的志愿者粪便,制成匀浆对HFD C57BL-6J小鼠进行粪菌移植(图6A)。小鼠分为对照组小鼠(HFD+ME 0M组)和干预组小鼠(HFD+ME 12M组)。结果发现,两组的饮食摄入量不受粪菌移植操作的影响。HFD+ME 12M组小鼠体重增长率降低(图6B),脂肪组织重量降低(图6C)。白色脂肪组织的组织切片显示,HFD+ME 12M组的脂肪细胞直径明显小于HFD+ME 0M组(图6D)。另外,HFD+ME 12M组的白色脂肪组织中参与脂肪生成的基因(包括Srebf1、Scd1和Fasn)显著降低,而参与脂肪分解和脂肪酸氧化的基因(包括Adrb3、Pnpla2、Acox1和Ppargc1a)表达显著升高(图6E)。
此外,炎症因子(Cd68、Ccl2、IL-6和IL-1β)在HFD+ME 12M组的脂肪组织中表达减弱,表明炎症状态有所改善(图6F)。口服葡萄糖耐量实验(OGTT)显示,在HFD+ME 12M组中没有改善葡萄糖不耐受的效果,但胰岛素抵抗指标(HOMR-IR)在HFD+ME 12M组中降低;尽管通过胰岛素耐量试验(ITT)的葡萄糖浓度曲线下面积(AUC)显示胰岛素敏感性无显著性改变。但重要的是,在粪菌移植第6周开始,HFD+ME 12M组就出现FBG水平显著降低,且胰岛素水平显著降低(图6I、6J)。此外,瘦素和脂联素在两组间无差异。AAs检测结果显示,HFD+ME 12M组中的L-谷氨酸和L-天冬氨酸显著降低,L-谷氨酰胺显著升高(图6K、6L),而L-缬氨酸变化不显著。16S rDNA扩增子数据表明,菌群移植后小鼠的肠道菌群组成与供体的肠道菌群组成相似;在第8周时,HFD+ME 12M组的Firmicutes/Bacteroidetes比例显著低于HFD+ME 0M组,但两组间Proteobacteria的相对丰度未发生明显变化。此外,通过用微生物数据建立的OPLS回归模型可以很好地预测小鼠临床指标变化,尤其是FBG、胰岛素、L-谷氨酸和L-天冬氨酸水平,但不能预测L-谷氨酰胺水平(图6M~6P),表明粪便供者的肠道菌群组成能够较好地预测粪菌移植受体的临床指标变化。FBG和HOMR-IR的减少表明中等海拔暴露后的肠道菌群在维持血糖代谢稳态方面有重要的因果作用,这将有助于降低T2DM的发病率。
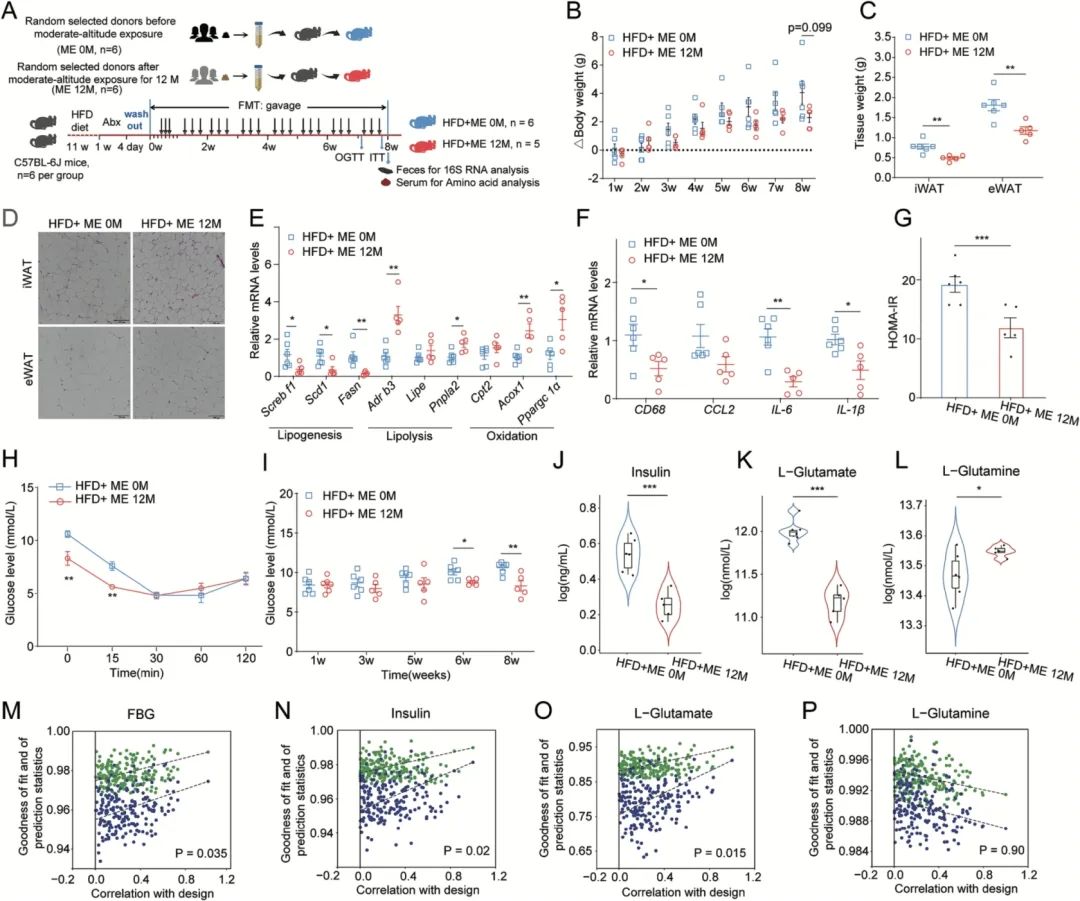
图6. 肠道菌群移植对HFD小鼠代谢表型的影响
讨论
高原地区T2DM发病率低于平原地区[3],但中等海拔暴露对血糖稳态调控的底层机制仍未可知。既往基于糖尿病患者和动物模型的研究表明,拟杆菌(Bacteroidales)家族的细菌越多、L-谷氨酸越少、L-谷氨酰胺越多,个体的胰岛素抵抗水平越低[4];粪便丙酸含量越高,个人的胰岛素抵抗水平越高;变形菌门(Proteobacteria)的细菌越多,代谢综合征发生率越高。而在本研究中,中等海拔暴露可改善血糖调控稳态和肥胖状态(如体重、BMI、LDL等降低)。其中蕴含的调控机制可能是:中等海拔暴露显著性增加个体肠道拟杆菌水平、降低L-谷氨酸和L-缬氨酸的合成、增加L-谷氨酰胺生成、降低血清丙酸含量,同时减少变形菌门的细菌,最终导致了FBG水平的降低。
研究团队进一步采用中等海拔暴露12个月的参与者粪便样本对HFD小鼠进行粪菌移植,结果表明可降低小鼠的FBG和HOMA-IR,并降低小鼠的血清L-谷氨酸及粪便Firmicutes/Bacteroidetes比例。这进一步验证菌群在高原暴露调节血糖代谢中的因果作用,可能是通过降低循环L-谷氨酸等代谢物水平实现的。
值得注意的是,Qiao等发现拟杆菌(例如Bacteroides xylanisolvens、B. thetaiotaomicron、B. dorei、B. uniformis)可通过影响叶酸合成调控肝脏功能,进而缓解非酒精性脂肪性肝病(NAFLD)的发生[5];Qian等、Yoshida等发现B. thetaiotaomicron、B. dorei、B. uniformis能够抑制炎症因子(如TNF-α、IL-6)表达,通过阻止脂多糖进入血液循环来维持肠道屏障的完整性[6-7];Ni等发现L-缬氨酸能够显著增加HepG2细胞内甘油三酯含量,降低脂质氧化降解基因表达,增强脂质合成基因表达,可能是Bacteroides stercoris促进肝脏脂肪堆积和NAFLD的发病机制之一[8]。在本研究中,中等海拔暴露的个体中,B. thetaiotaomicron、B. dorei、B. uniformis及其参与的叶酸合成通路“1CMET2- PWY: N10-formyl-tetrahydrofolate biosynthesis”增高,血清L-缬氨酸含量降低。这些提示,中等海拔暴露可能能够通过影响肠道拟杆菌、叶酸代谢、L-缬氨酸代谢、肠道屏障等方面缓解NAFLD。
这一研究首次扩展了中等海拔暴露-肠道菌群-宿主代谢-血糖调控之间关系的见解,为预防或治疗胰岛素抵抗相关的代谢综合征和心血管疾病的发生发展提供了理论支持。未来可能基于此开发出糖尿病前期患者短期高原旅居、中等海拔暴露后特定肠菌菌种或AAs补充等防治血糖代谢失衡的干预方式。
参考文献略
专家介绍

李欣
广东省人民医院,教授/主任医师,博士,博士生导师
现任广东省人民医院(广东省医学科学院)党委常委,急诊科学术带头人;华南理工大学医学院学术委员会成员。兼任中国医师协会急诊分会委员;中国医师协会急诊分会质控学组副主委;广东省医师协会急诊分会副主委;广东省医学会急诊分会常委,广东省健康管理学会急诊与灾难医学分会副主委。于2006~2007年在香港大学脑与认知科学国家重点实验室做Research Assistant,接受过系统的科研培训。2016年作为广东省医疗人才组团式援藏队队长,兼林芝市人民医院院长,带领西藏林芝市人民医院以优异的成绩通过了三级甲等医院的评审。2017年获评国家卫生计生突出贡献中青年专家,2018年获评广东省医学领军人才暨杰出青年人才,2019年获西藏自治区五一劳动奖章、优秀援藏干部称号,是广东省暨西藏自治区援藏首席专家。《中华急诊医学杂志》编委、Resuscitation、American Journal of Emergency Medicine审稿人。至今主持国家科技部重点研发课题1项和国家自然科学基金项目7项、省自然及省科委重点攻关项目等10余项。已发表第一作者或通讯作者SCI收录论著60余篇,包括European Heart Journal、Allergy、Aging Cell、Journal of Nanobiotechnology、Critical Care Medicine、Stem Cells、Resuscitation等国际期刊。出版学术专著8部,其中主编6部。

陈思凡
中山大学“百人计划”引进人才,中山大学孙逸仙纪念医院医学研究中心研究员
博士毕业于德国海德堡大学,博士后工作于哈佛医学院附属波士顿儿童医院。兼任中国生物物理学会肠道菌群分会理事、代谢生物学分会青年理事,中国生物化学与分子生物学学会代谢专委会委员,广东省医学会肥胖代谢外科学分会肥胖组副组长。兼任国际学术杂志Bio integration、iMeta、Medicine in microecology编委会成员,兼任FASEB Journal、Nutrition Journal、Biomolecules等杂志审稿人。主持国自然优青、广东省杰青、广州市重点研发项目、入选中山大学孙逸仙纪念医院“三个三”工程青年学术骨干等项目。获得中华医学会糖尿病学分会年度优秀论文奖、广州市科技进步奖、国家优秀自费留学生奖学金等荣誉。聚焦于糖尿病的代谢调控、并发症防治及药物开发研究。以通讯或第一作者在Cell Metabolism(2篇)、Molecular Cell、Signal Transduction and Targeted Therapy、Nature Communications、FASEB Journal等杂志发表论文。

刘志鹏
上海百趣代谢组学技术研究中心研究员
现任上海百趣生物医学科技有限公司多组学产品线总监,兼任国际学术杂志iMeta编委会成员。聚焦于肠道微生物、代谢组、转录组、蛋白质组等与复杂疾病的跨组学研究,致力于人体肠道微生态与临床代谢组相关的科学研究和应用转化研究。参与完成多项国家自然科学基金、国家科技部973、载人航天工程等重大项目;已在Nature Medicine、Nature Communications、Gut、Food Research International等杂志发表论文近10余篇,研究成果被Nature Reviews Endocrinology、Nature Reviews Cardiology等杂志评论。参编完成“十三五”规划教材1部,参编完成学术专著1部,参与完成的“绿航星际”项目相关成果于2018年入选科普读物《飞舟日记-“太空180试验”》、于2020年入选中国高中生教学教材《2020-2021学年高一新教材地理必修第一册》“第一章:宇宙中的地球”、于2023年入选中国国家博物馆:逐梦寰宇问苍穹—中国载人航天工程30年成就展。申请国际PCT专利5项,已获授权国际PCT专利4项,已获授权国内专利2项,曾获2项国际基因工程机械大赛IGEM金奖。

刘丹
中山大学孙逸仙纪念医院,副教授/主任医师,博士、博士后,硕士生导师
现任内分泌内科糖尿病专科副主任。2020年获第六届“羊城好医生”称号。中华医学会糖尿病学分会糖尿病足与周围血管病学组委员,国际血管联盟中国分部糖尿病足专家委员会委员,广东省健康管理学会老年医学与抗衰老专业委员会委员,广东省健康管理学会血管病专业委员会委员,广东省介入性心脏病学会周围血管分会委员,中国生物物理学会低氧与健康科学分会委员。长期从事临床医疗诊治工作,擅长内分泌及代谢病包括糖尿病、甲状腺疾病、性腺疾病、垂体肾上腺疾病等的诊治。在糖尿病诊治领域,已熟练掌握糖尿病下肢动脉病变介入诊疗技术,尤其擅长糖尿病外周血管病变和糖尿病足的诊治。近年来主要承担的临床研究课题为《下肢血管腔内治疗对糖尿病足溃疡或坏疽预防作用的初步探讨》。











 京公网安备 11010502033361号
京公网安备 11010502033361号
发布留言