一、独特机制:胰岛是GKA重要靶点,多格列艾汀改善β细胞葡萄糖敏感性及胰岛素分泌功能受损
T2DM发病机制复杂,胰岛β细胞功能障碍导致的胰岛素分泌功能受损是其核心病理生理机制。因此,阻止β细胞功能下降和恢复功能性β细胞数量,被认为是理想的糖尿病治疗策略。临床上尽早采取有效措施保护β细胞功能,对于延缓T2DM进展具有重要意义。多格列艾汀是一种作用机制新颖的降糖药物,可直接作用于胰岛β细胞的GK靶点,在有效降糖的同时,显示出一定的β细胞保护作用。
GK可催化葡萄糖磷酸化生成葡萄糖-6-磷酸,是机体维持血糖稳态的重要传感器,在调节胰岛β细胞分泌胰岛素、α细胞分泌胰高糖素、肝脏葡萄糖代谢和肠促胰素分泌中起重要作用[1]。多格列艾汀通过作用于血糖调控核心器官(胰岛、肝脏、肠道)中的GK靶点,葡萄糖浓度依赖性地促进胰岛素分泌、抑制胰高糖素释放、促进GLP-1分泌和肝糖原合成[1]。其中,胰岛是多格列艾汀的重要作用靶点。在葡萄糖刺激的胰岛素分泌(GSIS)信号通路中,多格列艾汀可结合于GK的活性调节位点以提高GK活性,从而提升葡萄糖磷酸化转化速率,促进细胞内ATP产生,以保证β细胞分泌胰岛素所需能量(图1);并提高β细胞对葡萄糖变化的感知能力,改善受损的GSIS能力[1,2]。
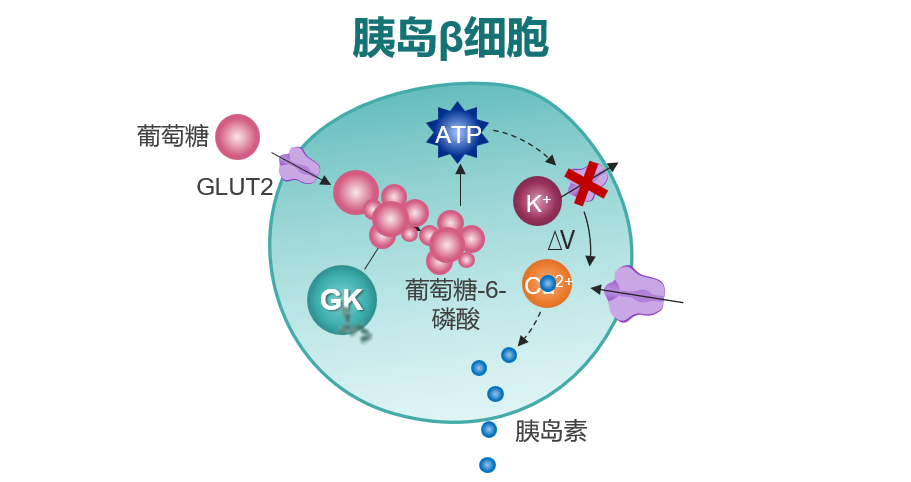
二、循证支持:从基础到临床研究,多格列艾汀展现出对胰岛β细胞的保护作用
随着研究的不断开展和深入探索,GKA对β细胞的保护作用已得到越来越多的证据支持。从基础研究、随机对照临床研究(RCT)到研究者发起的研究(IIT),一系列研究逐步构建起完整的证据链,进一步巩固并丰富了其科学依据。下面将对此进行全面梳理。
01、基础研究
在一项评估多格列艾汀治疗对T2DM影响的动物研究中,与糖尿病组相比,多格列艾汀治疗组(低剂量组和高剂量组)的功能性胰岛β细胞数量显著增多,其中高剂量组功能性β细胞数量可恢复至正常水平的75%[3]。另有一项离体人胰岛灌注实验评估了GKA对T2DM供体胰岛功能的影响。结果发现,T2DM患者葡萄糖刺激的胰岛素分泌功能受损,机体对葡萄糖变化的反应变得“迟钝”,胰岛β细胞不能及时、足量地分泌胰岛素,表现为GSIS曲线阈值右移,而多格列艾汀干预后可改善T2DM患者受损的GSIS阈值和总体胰岛素分泌(图2),提示其有助于改善胰岛β细胞的胰岛素分泌功能[2]。
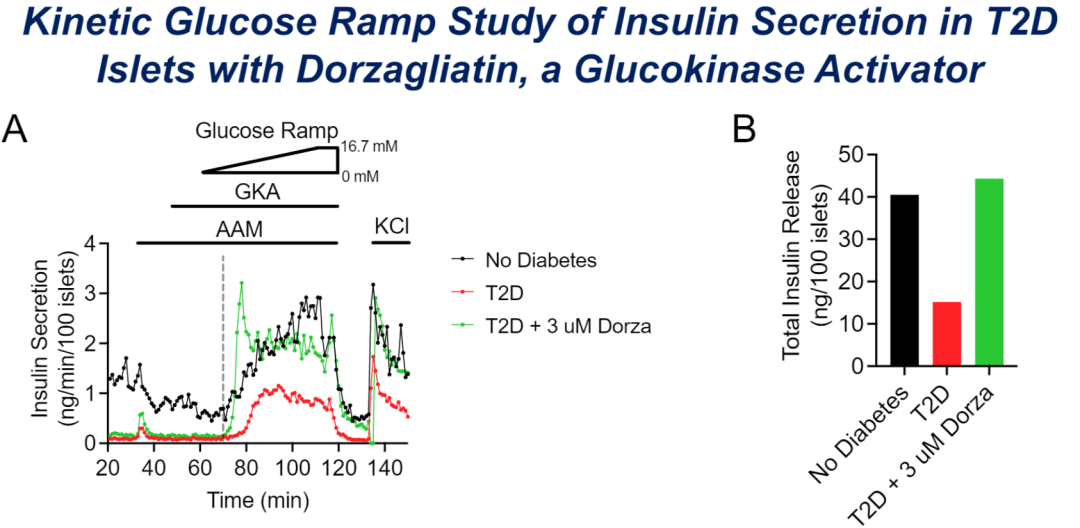
图2. 多格列艾汀改善T2DM患者GSIS阈值和总体胰岛素分泌
02、RCT研究
多格列艾汀治疗T2DM患者的Ⅰ~Ⅲ期临床研究中,均观察到GKA对于胰岛β细胞的保护作用。
Ⅰ期临床研究
在采用多剂量递增给药方式的Ⅰb期临床研究中,T2DM患者接受不同剂量多格列艾汀治疗7天后,早相胰岛素分泌均得以改善,分泌时相前移,分泌峰值升高(图3)[4]。在评估多格列艾汀75 mg剂量方案的Ⅰc期临床研究中,T2DM患者经过28天治疗并停药3天,与基线比较,多格列艾汀75 mg BID治疗使稳态模型评估胰岛β细胞功能指数(HOMA2-β)升高36.31%,早相胰岛素分泌指数(ΔC30/ΔG30)升高24.66%,提示多格列艾汀显著改善胰岛β细胞功能及胰岛素早相分泌[5]。
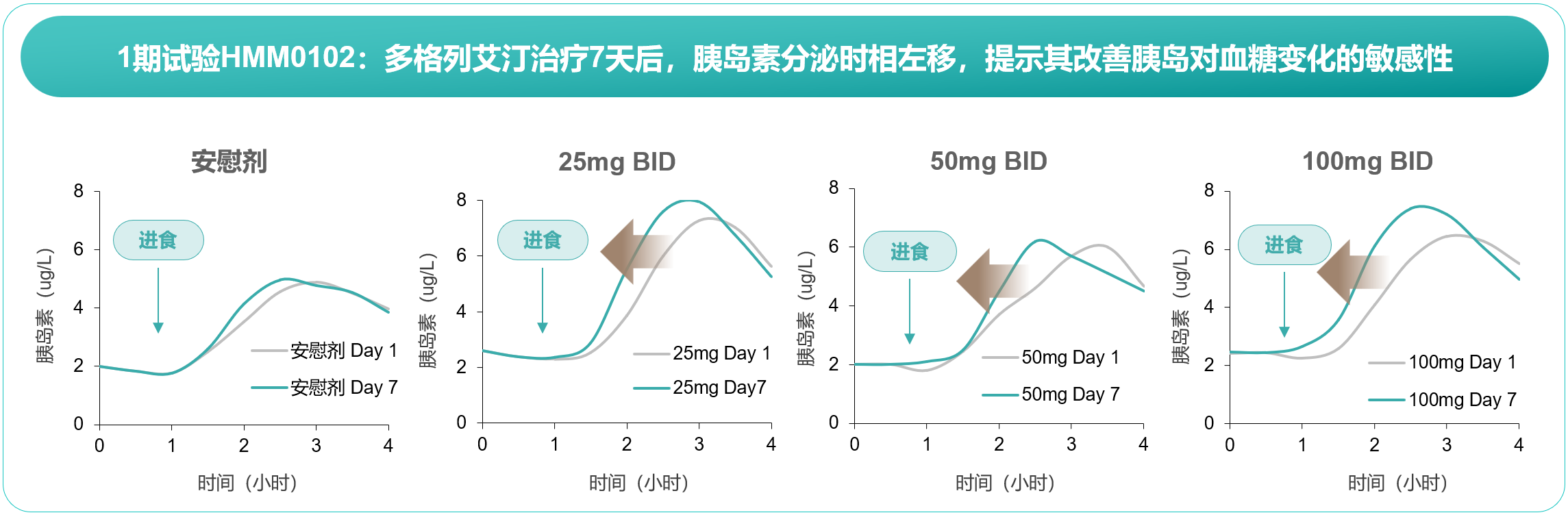
Ⅱ期临床研究
Ⅱ期临床研究结果显示,相比安慰剂,T2DM初治患者应用多格列艾汀75 mg BID治疗12周,稳态模型评估胰岛素抵抗指数(HOMA-IR)显著下降,葡萄糖处置指数(DI)显著升高;而且,第13周时(即治疗结束后1周)β细胞功能仍持续改善(图4)[6]。
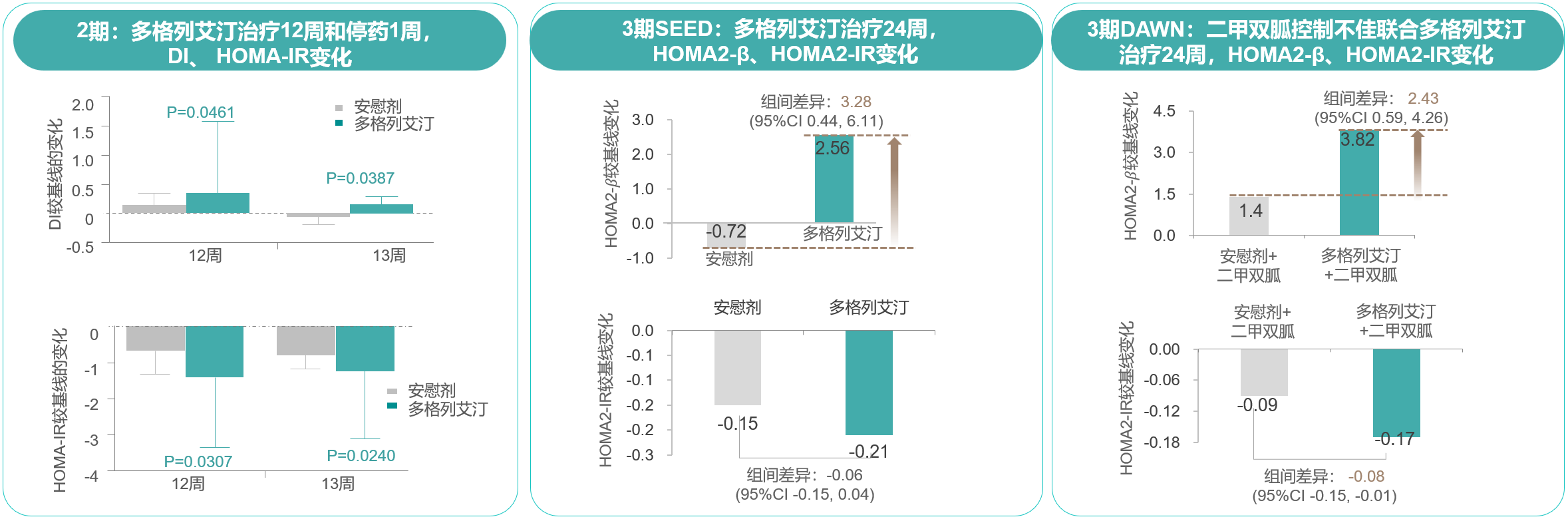
图4. Ⅱ/Ⅲ期研究:多格列艾汀改善T2DM患者多项胰岛β细胞功能指标
Ⅲ期临床研究
两项Ⅲ期临床研究SEED和DAWN研究结果显示,T2DM患者应用多格列艾汀单药或联合二甲双胍治疗24周,HOMA2-β均得到显著改善(图4)[7,8]。
这两项Ⅲ期研究的事后分析进一步证实,多格列艾汀对早相胰岛素分泌的改善是T2DM患者血糖达标的独立因素,该研究采用胰岛素生成指数(IGI30min)和DI来评估早相胰岛素分泌功能,采用Logistic回归分析验证IGI30min和DI对实现有效血糖控制的重要性。结果显示,多格列艾汀治疗24周后,IGI30min及DI均与HbA1c<7%达标显著相关,IGI30min或DI每增加1个单位,患者实现HbA1c达标的概率可分别提高24%和30%(图5)[9]。
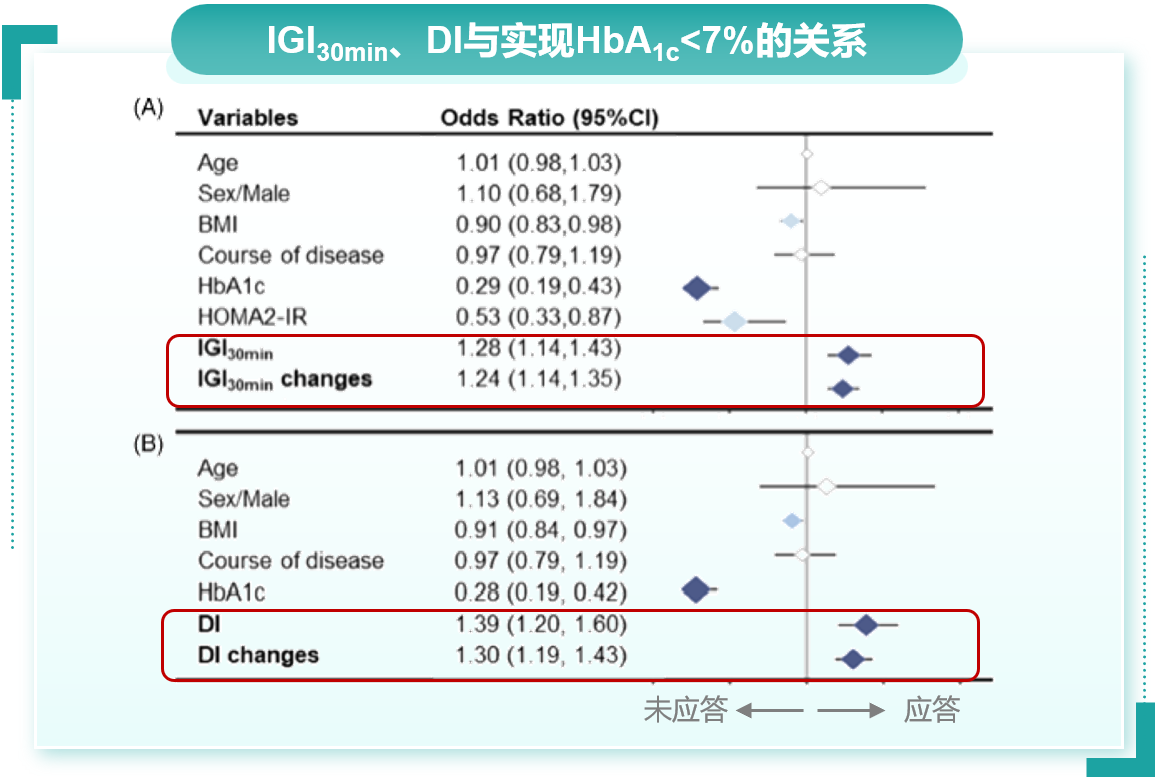
以上基础研究和临床研究一致支持,多格列艾汀能够增加胰岛β细胞数量,改善受损的GSIS功能,显著改善早相胰岛素分泌,改善胰岛β细胞功能和胰岛素抵抗,这些作用不仅对维持血糖稳态具有重要意义,而且可能有着超越降糖的更多价值,例如在停药后维持血糖控制、有助于疾病缓解。
03、IIT研究
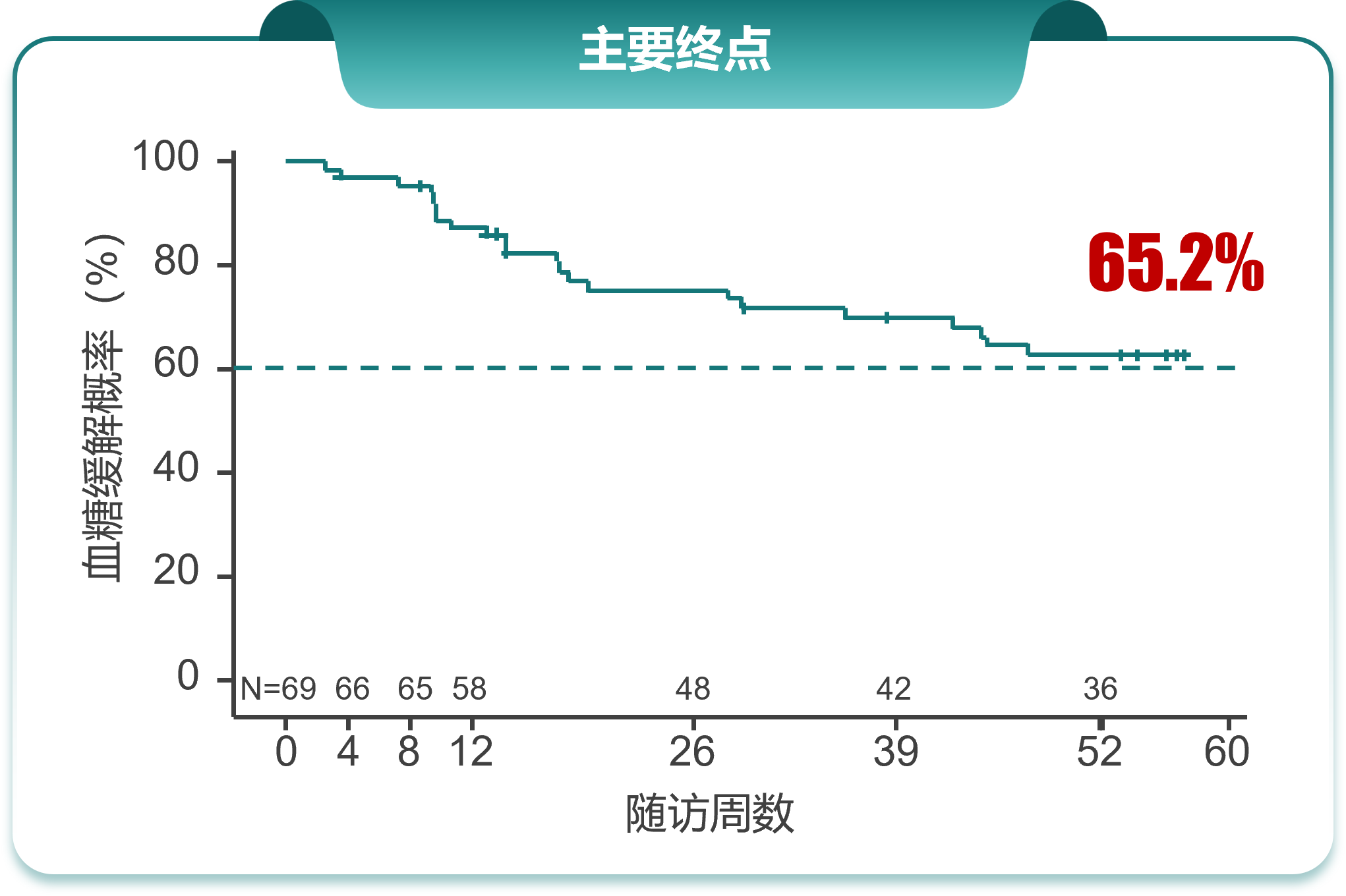
三、结语及展望
T2DM发生发展与胰岛β细胞功能损伤密切相关,保护胰岛β细胞功能是重要策略。GKA多格列艾汀具有全新的独特作用机制,不仅可改善血糖稳态,帮助T2DM患者实现良好血糖控制,而且具有一定的胰岛β细胞保护作用,这已得到从机制到循证、从基础到临床研究的完整证据链支持。将来,如何更好发掘和利用GKA的临床价值是一项重要课题,临床上T2DM患者早期及联合应用GKA可能有助于延缓疾病进展,但仍需通过大规模研究进一步验证。
参考文献
1.《多格列艾汀临床应用专家指导意见》专家组. 中华糖尿病杂志. 2023; 15(8): 703‑706.
2. Roman J, et al. Diabetes. 2023; 72(Suppl 1): 293-LB.
3. Wang P, et al. J Diabetes Res. 2017; 2017: 5812607.
4. Zhu DL, et al. ADA 75th Scientific Session, June 5-9, 2015, Boston.
5. Zhu XX, et al. Diabetes Obes Metab. 2018; 20(9): 2113-2120.
6. Zhu D, et al. Lancet Diabetes Endocrinol. 2018; 6(8): 627-636.
7. Zhu D, et al. Nat Med. 2022; 28(5): 965-973.
8. Yang W, et al. Nat Med. 2022; 28(5): 974-981.
9. Feng L, et al. Diabetes Obes Metab. 2024; 26(2): 745-753.
10. Zeng J, et al. Diabetes Obes Metab. 2023; 25(10): 2878-2887.
11. Jingcheng Chen, et al. ADA Poster 2025: 1816-P.
12. 汪可. 葡萄糖激酶激活在延缓衰老中的潜力——一项双样本孟德尔随机化研究. OR-207. 论文交流:糖尿病遗传学、转化医学、精准医学 2. CDS 2025
2 comments










 京公网安备 11010502033361号
京公网安备 11010502033361号
发布留言