编者按:肥胖是全球正在面临的重大公共卫生问题,近年来多项研究证实,肥胖与维生素D缺乏之间存在密切关联。2025北大糖尿病论坛学术分享交流会暨海岸长桥代谢疾病研究交流会期间,福建医科大学附属第一医院黄凌宁教授带来深度分享,系统解析了肥胖与维生素D缺乏的相关性研究,探讨二者关联的潜在生理机制,并就肥胖人群维生素D缺乏的的临床管理现状,现存挑战及未来方向提出思考与展望。

福建医科大学附属第一医院内分泌科 主任医师 副教授 硕士研究生导师 医学博士
福建医科大学代谢病研究所 副所长
福建省医学会内分泌学分会 常务委员
福建省中西医结合学会骨质疏松分会 常务委员
福建省医师协会内分泌代谢科医师分会委员
中华医学会糖尿病学分会糖尿病与其他内分泌疾病学组委员
《中国医师杂志》通讯编委
《中华糖尿病杂志》审稿专家
一、相关研究:肥胖与维生素D下降密切相关
近50年来,全球人群肥胖率均呈不同幅度的增长,我国目前已成为超重或肥胖人数最多的国家[1]。多项研究显示,肥胖人群维生素D缺乏的患病率高于正常体重人群[2]。
一项涵盖21项研究的综合分析显示,无论处于哪个年龄组,肥胖人群的维生素D缺乏的患病率均比正常体重人群高出35%,但各年龄组的超重和肥胖人群出现维生素D缺乏症的概率相近——这意味着年龄对肥胖与维生素D缺乏的关联性影响并不显著。欧洲一项研究也显示,智利4~14岁儿童血清25(OH)D缺乏症的患病率高达80.4%,其中肥胖/超重儿童的患病率最高[3]。
更多研究进一步明确了肥胖与维生素D下降关系密切:
遗传分析显示,体重指数(BMI)每增加10 kg/m2,血浆25(OH)D水平降低11.1 nmol/L;且高BMI相关的遗传变异对糖尿病产生的影响,部分是通过降低血浆25(OH)D浓度来介导的[4]。
英国伦敦大学儿童健康研究所的双向孟德尔随机化分析显示,较高的BMI会导致较低的25(OH)D水平,而较低的25(OH)D水平对BMI的反向影响则较小[5]。
弗莱明汉心脏研究的横断面数据显示,维生素D缺乏的患病率随着内脏脂肪增加而上升[6]。
国际和平妇幼保健医院的一项回顾性队列研究显示,在维生素D缺乏/不足组中,孕早期胎儿头臀长(CRL)显著降低,相比维生素D充足组,早期胎儿生长发育受限(FGR)风险增加13%。在超重/肥胖组中,孕早期CRL同样显著降低,与正常体重组相比,早期FGR风险显著增加58%[7]。
二、肥胖与维生素D相关的潜在机制
人体获取维生素D主要通过3大途径,即日照合成(占80%)、食物摄取和营养补充剂。具体代谢过程如下:当紫外线(UVR)照射皮肤时,皮肤中的7-脱氢胆固醇会转化为胆钙化醇(即维生素D3),后者经血液进入肝脏后,与食物摄取或补充剂摄入的外源性维生素D一同在细胞色素P450酶(CYP2R1、CYP27A)的作用下完成第一次羟化,生成25-羟维生素D3[25(OH)D3]。
生成的25(OH)D3有两大去向:一部分进入肾脏,在CYP27B编码的1α羟化酶作用下完成第二次羟化,形成具有生物活性的1,25-二羟维生素D3[1,25(OH)2D3],进而发挥生理作用;另一部分25(OH)D3则储存在脂肪组织中备用,当体内活性维生素D[1,25(OH)2D3]不足时,储存的25(OH)D3会在CYP27B的作用下继续活化,补充活性形式的需求。
血清25(OH)D3是评估人体维生素D营养状态的重要生物标志物。由于肥胖人群体内脂肪组织含量丰富,对25(OH)D3的储存能力更强,大量25(OH)D3会被脂肪组织截留,导致血液循环中的25(OH)D3水平反而偏低,这也是肥胖与维生素D缺乏密切相关的重要基础。
基于维生素D的代谢途径,研究认为肥胖人群维生素D缺乏的潜在机制主要涉及以下几方面[8]:
1.肥胖症者日晒频率减少,更易出现维生素D缺乏。来自弗莱明汉心脏研究的横断面数据显示,对个体而言,即使调整了运动和维生素D摄入因素,血清25(OH)D水平仍与内脏脂肪量、皮下脂肪量呈负相关,这表明单纯的日晒或户外运动减少,不足以解释肥胖者缺乏维生素D的现象。但不可否认的是,若肥胖人群本身日晒频率更低,会进一步增加维生素D缺乏的可能性[6]。
2.脂肪堆积截留维生素D,降低生物利用度。一项研究对肥胖组与对照组受试者进行27 mJ/cm2的紫外线B全身照射,比较两组照射前及照射后24小时的血清维生素D3浓度均值变化;随后让受试者口服50,000 IU(1.25 mg)维生素D2,观察0~25小时内两组血清维生素D2浓度均值的变化情况。结果显示,照射后24小时,肥胖组的血清维生素D3浓度均值及升高幅度均低于对照组;口服维生素D2后,肥胖组血清维生素D2浓度均值同样低于对照组,且随着BMI升高,该浓度均值呈逐渐降低趋势[9]。
3.肥胖人群CYP2R1和CYP27B酶活性降低,削弱维生素D活化能力。CYP2R1编码25-羟化酶,CYP27B编码1α羟化酶,二者均是维生素D活化过程中的关键酶。一项动物实验结果显示,高脂饮食组小鼠肝脏中CYP2R1 mRNA表达水平显著降低;且CYP2R1 mRNA水平与血清25(OH)D浓度呈显著正相关,与循环中25(OH)D3/胆钙化醇比值呈显著负相关。此外,瘦小鼠肝脏的25-羟化酶活性显著高于肥胖小鼠,高脂喂养小鼠的肝脏25-羟化酶活性则明显降低[10]。这提示,高脂饮食与肥胖可能通过影响CYP2R1、CYP27B的功能,削弱维生素D的活化能力。
4.脂肪组织局部对维生素D的利用增加。
5.减重手术相关的吸收障碍。部分肥胖患者接受减重手术后,可能会出现包括维生素D在内的多种营养素吸收障碍,进而加重维生素D缺乏的情况。
三、肥胖人群维生素D缺乏的管理思考
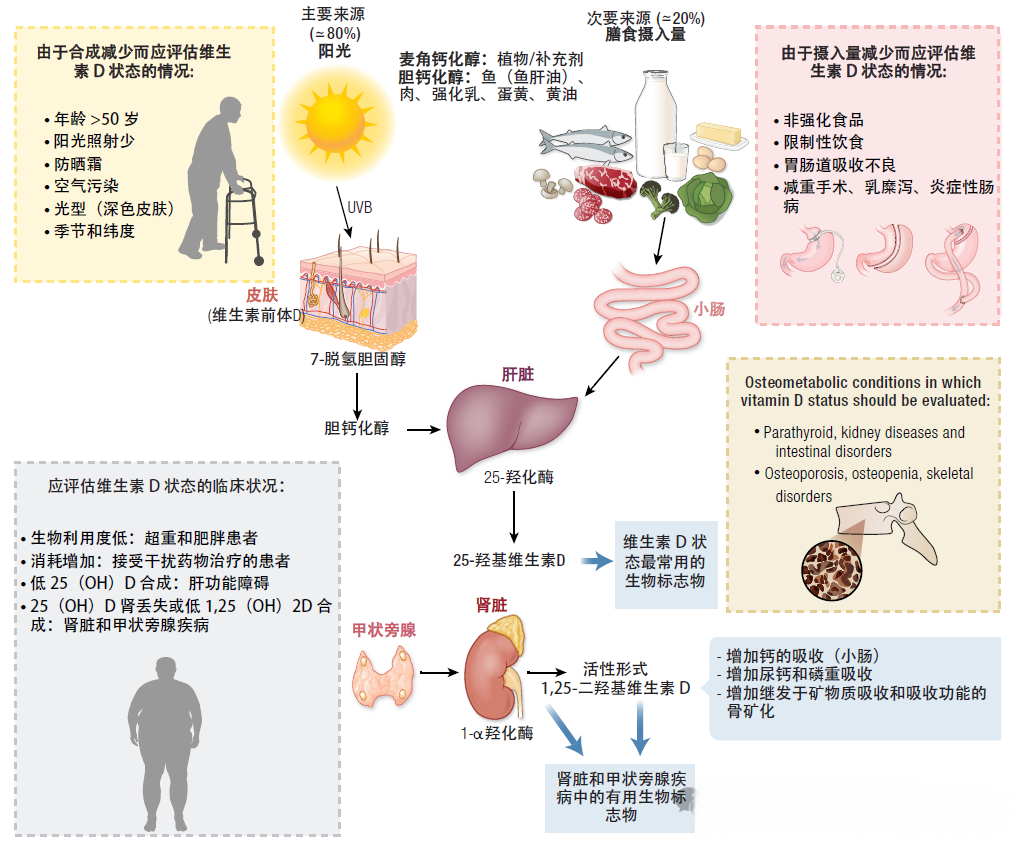
图1. 维生素D代谢过程及影响因素
维生素D水平受多种因素影响,包括维生素D合成减少、摄入不足、疾病状态等(图1)。其中,肥胖和高腰围是维生素D缺乏的明确高危因素。临床研究证实,及时为肥胖患者补充充足的维生素D,可带来多重健康获益:不仅能增加抗炎脂肪因子、减少促炎细胞因子,还能促进β细胞分泌胰岛素,提升脂联素与胰岛素样生长因子-1(IGF-1)的分泌水平,同时减少肝内甘油三酯堆积,避免肾素-血管紧张素系统(RAS)异常激活。
但现实问题是,尽管我们认识到为肥胖患者补充维生素D获益良多,但在实际应用和临床管理过程中仍面临诸多待明确的细节问题:例如高危人群的筛查频率如何设定、补充治疗的启动时机与适宜周期、血清25(OH)D的目标控制范围、治疗后的复查频率与调整方案等,这些关键问题均需更多临床研究数据支撑,以形成标准化的管理路径,任重而道远。
综上所述,现有大量研究已充分证实肥胖与维生素D缺乏关系密切,及时为肥胖这一高危人群开展维生素D筛查与补充,对改善健康结局具有重要意义。同时,肥胖作为糖尿病、高血压、心脑血管疾病等多种慢性病的共同危险因素,其科学管理不仅能改善维生素D缺乏状况,更能间接助力多种慢性病的防控。因此,思考如何将慢性病治疗关口前移、做好早期综合管理至关重要,期待未来能有更多的科研成果转化为临床可落地的干预方案,为公共卫生事业发展提供有力支撑。
参考文献
[1] 2020年《中国居民营养与慢性病状况报告》
[2] Obes Rev. 2015 Apr;16(4):341-349.
[3] European Journal of Clinical Nutrition. (2022) 76:899-901
[4] Lancet Diabetes Endocrinol. 2014 Apr;2(4):298-306.
[5] PLoS Med. 2013;10(2):e1001383.
[6] Diabetes. 2010 Jan;59(1):242-248.
[7].European Journal of Nutrition. (2022) 61:915-924.
[8] Nutrients. 2021, 13, 4127.
[9] Am J Clin Nutr. 2000;72:690-693.
[10] J Bone Miner Res.2019 Jun;34(6):1068-1073.
2 comments











 京公网安备 11010502033361号
京公网安备 11010502033361号
发布留言