编者按:美国糖尿病协会(ADA)年会作为全球糖尿病领域具有影响力的学术盛会之一,聚焦于降糖药物的机制创新与临床应用。二甲双胍作为2型糖尿病(T2DM)治疗的基本药物,历经60余年临床验证,其“老药新用”的探索从未停止。在ADA 2025年会上,一场以“二甲双胍真正分子靶点”为主题的专题讨论会,深入剖析了二甲双胍的分子靶点之谜,同时两项临床研究首次披露了其在认知功能保护与老年虚弱干预中的突破性进展。本刊邀请复旦大学附属华山医院内分泌科李益明教授,从分子机制到临床应用,梳理ADA 2025年会上二甲双胍的研究脉络。
01.二甲双胍与肝糖异生的调控
二甲双胍口服后作用于肝脏和肠道,已知通过抑制肝脏糖异生(对糖原分解无影响)来减少肝葡萄糖输出。但具体的作用机制尚不明确。法国Benoit Viollet 教授本次汇报[1]聚焦于探究二甲双胍调控肝糖异生的具体机制。通过不同研究分析二甲双胍的生物分布,利用碳13核磁共振(13C NMR)等技术检测内源性葡萄糖生成、肝糖原分解和糖异生情况,发现二甲双胍可使肝葡萄糖生成降低16%~26%,作用机制包括:通过抑制线粒体复合物Ⅰ,提高AMP:ATP和NADH:NAD+比率,激活AMPK,抑制果糖-1,6-二磷酸酶(FBP1),减少糖异生相关基因表达;通过调节氧化还原状态,影响甘油-3-磷酸脱氢酶等发挥作用。二甲双胍具有AMPK依赖与非依赖的作用机制,因为敲除腺苷酸活化蛋白激酶(AMPK)并不能阻止二甲双胍的所有作用。然而,肝脏胰岛素敏感性的提高确实有赖于AMPK的激活。此外,肠道可能也参与其降血糖效应,二甲双胍诱导的胰高糖素样肽-1(GLP-1)释放,刺激迷走神经纤维,改变新陈代谢,增加的生长分化因子15(GDF15)可能会降低食物摄入量和体重。
02.二甲双胍对线粒体作用的分子机制
美国Navdeep S. Chandel教授的汇报[2]聚焦于二甲双胍如何通过作用于线粒体复合物I影响代谢及健康效应。既往已知二甲双胍可逆抑制线粒体复合物Ⅰ,酵母NDI1蛋白可绕过复合物Ⅰ抑制,维持线粒体呼吸链功能。二甲双胍并不抑制NDI1。因此,在小鼠中过表达NDI1可作为探索二甲双胍对线粒体依赖性效应的模型。通过抑制线粒体复合物Ⅰ,二甲双胍可能促进葡萄糖从血循环向肠道细胞转移(即促进肠道排糖)而降低餐后血糖,升高GDF15水平。二甲双胍还通过抑制癌细胞线粒体复合物Ⅰ,影响肿瘤代谢,抑制肿瘤生成,降低克隆性造血风险。二甲双胍还可能通过这种机制减少空气污染引起的血栓形成。综上,二甲双胍通过可逆抑制线粒体复合物Ⅰ发挥多重生理效应,其作用靶点主要位于线粒体。该抑制作用可调节能量代谢、影响代谢物释放,进而发挥血糖调控、抑制肿瘤及降低相关疾病风险。
03.二甲双胍与炎症的交汇点
T2DM和肥胖常伴随着慢性炎症。美国Barbara Nikolajczyk教授在报告[3]中主要提出以下观点:(1)CD4+ T细胞主导炎症:在T2DM中,CD4+ T细胞分泌的Th17相关细胞因子(如IL-17A、IL-17F)是外周炎症的主要驱动因素。(2)二甲双胍的作用差异:在ANTHEM研究中,肥胖和胰岛素抵抗是影响二甲双胍对T细胞炎症作用的重要调节因素。在胰岛素抵抗肥胖个体中,二甲双胍对T细胞的细胞因子谱产生了深远影响,可降低Th17相关细胞因子(如IL-17A、GM-CSF),并激活CD4+ T细胞自噬改善炎症。二甲双胍并未改变胰岛素敏感肥胖个体的CD4+ T细胞产生的细胞因子。
04.二甲双胍与果糖代谢的关联
美国Mark A Herman教授的汇报[4]探究了小肠在果糖代谢中的作用,以及二甲双胍对果糖代谢的影响。肝脏和小肠是果糖代谢的主要场所,给动物注射果糖会诱导严重的胰岛素抵抗和高血压,口服果糖会改变肝脏中三羧酸(TCA)循环代谢物的模式。二甲双胍可改善饮食诱导肥胖小鼠的葡萄糖耐量,减少门静脉葡萄糖水平,减少果糖转化为葡萄糖。二甲双胍还能够减少果糖中碳原子向循环中的TCA循环代谢物的整合。
二甲双胍重塑脑代谢,逆转胰岛素抵抗相关认知衰退
胰岛素抵抗(IR)是阿尔茨海默病及其他痴呆症的重要危险因素。研究表明,二甲双胍可纠正饮食诱导IR所致的脑细胞线粒体功能异常,尤其在胰岛素受体富集的脑区。美国与韩国研究者以壁报[5]形式展示了经过10个月二甲双胍治疗对IR老年人群认知功能、脑网络连接、葡萄糖摄取及区域体积的影响。
研究纳入40例年龄60~80岁的受试者(20男/20女),伴腹型肥胖(BMI≥25 kg/m2 ,腰围男性>102 cm、女性>88 cm),空腹血糖100~125 mg/dl,随机分为二甲双胍组(2500 mg/d)与安慰剂组,干预40周。治疗前后的观察指标包括认知功能(NIH工具箱认知测试)、体积磁共振成像、静息态功能性磁共振成像、脑葡萄糖摄取(18FDG-PET)以及胰岛素敏感性(混合餐耐受性测试,MMTT)。
研究结果
认知功能与脑结构:二甲双胍显著改善工作记忆与处理速度,并减缓杏仁核和海马的体积萎缩,同时增加额叶及颞叶白质体积。
功能连接与代谢优化:IR程度与脑区(尤其额叶-颞叶结构)连接强度呈负相关,二甲双胍可减弱这一负相关性;在前额叶皮质等胰岛素受体富集区域的葡萄糖摄取显著增加,与全身胰岛素敏感性改善一致。
本研究首次在人体证实,二甲双胍可能改善与胰岛素抵抗相关的脑网络连接、脑容量和脑葡萄糖摄取,增强与记忆和其他认知功能相关的脑区的胰岛素敏感性,为认知功能障碍提供了新的治疗靶点(图1)。
衰老和糖尿病前期会损害胰岛素作用并促进脑胰岛素抵抗,导致线粒体功能障碍,既减少ATP生成(从而损害神经元能量供应和传导),又使活性氧(ROS)释放增加,这会驱动胰岛素受体富集区域发生氧化损伤和体积丢失;这两种情况共同作用可引发痴呆。通过增强胰岛素敏感性,二甲双胍可恢复细胞内能量稳态,可能预防或减轻痴呆。
(注:二甲双胍在中国尚未获批在非T2DM人群中使用)
二甲双胍延缓老年虚弱进程,开启健康老龄化新可能
虚弱是老年人致病和致残的主要原因,而IR是虚弱的重要危险因素。ADA 2025一项美国研究[6],通过随机双盲安慰剂对照试验,探讨了二甲双胍对糖耐量异常老年人群(≥65岁)虚弱的影响。
受试者随机接受24个月二甲双胍治疗(起始500 mg/d,滴定至最大耐受剂量,最大可达2000 mg/d)或安慰剂,并在入组前接受一次饮食和运动咨询。主要终点为基于缺陷累积模型的虚弱指数(frailty index)及Fried标准的虚弱表型来评估虚弱情况,每6个月评估一次。
研究结果
145例受试者被随机分组,141例符合意向性治疗分析集。用药方案为二甲双胍最高2000 mg/d或安慰剂治疗,随访24个月。基线特征显示,48%女性,35%西班牙裔/拉丁裔,平均年龄71.8±5.3岁。 二甲双胍组虚弱指数进展速率较安慰剂组显著降低(-0.0494 ± 0.0216,95%CI:-0.0918 ~ -0.0071,P=0.0222),但Fried标准未显示组间差异(0.0116 ± 0.0077, P=0.1302)。未观察到严重不良事件。
对于糖耐量异常老年人,二甲双胍可能有助于预防虚弱,为延长健康寿命提供了低成本、可行的潜在治疗策略,但不同虚弱评估工具的结果存在差异,未来需进一步明确获益人群与作用窗口期。
(注:二甲双胍在中国尚未获批在非T2DM人群中使用)
专家点评
从分子机制到临床获益,二甲双胍的多靶点作用突破治疗边界
ADA 2025年会上关于二甲双胍的研究突破,进一步拓展了其作为传统降糖药的应用范围。基础研究层面,可以看到大量研究成果,二甲双胍通过抑制线粒体复合物Ⅰ、激活AMPK通路、调节氧化还原状态及肠道果糖代谢等多靶点机制,实现对肝糖异生、炎症反应及能量代谢的精准调控,特别是肝脏和肠道作为药物高浓度聚集部位,相关研究较为充分,但二甲双胍肝外器官靶点的作用还有更多的研究。临床研究的壁报也有诸多亮点,如首次在人体证实,二甲双胍可改善胰岛素抵抗老年人群的脑内网络连接、认知功能并减缓脑结构萎缩,同时在老年糖耐量异常人群中显著延缓虚弱指数进展,为认知衰退和人口老龄化提供了低成本干预策略。这些研究展现了二甲双胍作用机制的复杂性和多样性,在代谢性疾病及年龄相关疾病中“多维度调控-跨器官获益”存在独特价值,为老药新用开辟了更广阔的研究前景与临床转化空间。
专家简介

李益明 教授
复旦大学附属华山医院内分泌科主任,主任医师,教授,博士生导师
中华医学会糖尿病学分会常委、糖尿病神经并发症学组副组长
中国医师协会内分泌代谢科医师分会委员
上海市康复协会糖尿病分会主任委员
上海市医学会内分泌分会副主任委员
上海市中医药学会糖尿病分会副主任委员
上海市中西医结合学会内分泌代谢病专业委员会副主任委员
《中国糖尿病杂志》和《中华糖尿病杂志》编委
《实用内科学》副主编、《harrisen内分泌学》共同主译
主要的研究方向为神经内分泌疾病诊治、糖尿病神经病变和肥胖胰岛素抵抗
参考文献:
1. Benoit Viollet, et al. Metformin and Hepatic Gluconeogenesis. ADA 2025.
2. Navdeep S. Chandel, et al. Metformin targets mitochondrial complex I to improve healthspan. ADA 2025.
3. Barbara Nikolajczyk, el al. The intersection of Metformin and inflammation. ADA 2025.
4. Mark Herman, et al. Metformin and Fructose metabolism. ADA 2025.
5. Ruegsegger G. Metformin Improves Brain Glucose Uptake, Network Connectivity, and Volume Concurrent to Improved Working Memory and Processing Speed in Insulin-Resistant Older Adults. ADA 2025, 879-P.
6. A Two-Year Trial of Metformin to Reduce Frailty in Older Adults with Glucose Intolerance. ADA 2025, 1998-LB.
审批号:CN-MET-00116 有效期到2027年6月24日
2 comments

01.二甲双胍与肝糖异生的调控
二甲双胍口服后作用于肝脏和肠道,已知通过抑制肝脏糖异生(对糖原分解无影响)来减少肝葡萄糖输出。但具体的作用机制尚不明确。法国Benoit Viollet 教授本次汇报[1]聚焦于探究二甲双胍调控肝糖异生的具体机制。通过不同研究分析二甲双胍的生物分布,利用碳13核磁共振(13C NMR)等技术检测内源性葡萄糖生成、肝糖原分解和糖异生情况,发现二甲双胍可使肝葡萄糖生成降低16%~26%,作用机制包括:通过抑制线粒体复合物Ⅰ,提高AMP:ATP和NADH:NAD+比率,激活AMPK,抑制果糖-1,6-二磷酸酶(FBP1),减少糖异生相关基因表达;通过调节氧化还原状态,影响甘油-3-磷酸脱氢酶等发挥作用。二甲双胍具有AMPK依赖与非依赖的作用机制,因为敲除腺苷酸活化蛋白激酶(AMPK)并不能阻止二甲双胍的所有作用。然而,肝脏胰岛素敏感性的提高确实有赖于AMPK的激活。此外,肠道可能也参与其降血糖效应,二甲双胍诱导的胰高糖素样肽-1(GLP-1)释放,刺激迷走神经纤维,改变新陈代谢,增加的生长分化因子15(GDF15)可能会降低食物摄入量和体重。
02.二甲双胍对线粒体作用的分子机制
美国Navdeep S. Chandel教授的汇报[2]聚焦于二甲双胍如何通过作用于线粒体复合物I影响代谢及健康效应。既往已知二甲双胍可逆抑制线粒体复合物Ⅰ,酵母NDI1蛋白可绕过复合物Ⅰ抑制,维持线粒体呼吸链功能。二甲双胍并不抑制NDI1。因此,在小鼠中过表达NDI1可作为探索二甲双胍对线粒体依赖性效应的模型。通过抑制线粒体复合物Ⅰ,二甲双胍可能促进葡萄糖从血循环向肠道细胞转移(即促进肠道排糖)而降低餐后血糖,升高GDF15水平。二甲双胍还通过抑制癌细胞线粒体复合物Ⅰ,影响肿瘤代谢,抑制肿瘤生成,降低克隆性造血风险。二甲双胍还可能通过这种机制减少空气污染引起的血栓形成。综上,二甲双胍通过可逆抑制线粒体复合物Ⅰ发挥多重生理效应,其作用靶点主要位于线粒体。该抑制作用可调节能量代谢、影响代谢物释放,进而发挥血糖调控、抑制肿瘤及降低相关疾病风险。
03.二甲双胍与炎症的交汇点
T2DM和肥胖常伴随着慢性炎症。美国Barbara Nikolajczyk教授在报告[3]中主要提出以下观点:(1)CD4+ T细胞主导炎症:在T2DM中,CD4+ T细胞分泌的Th17相关细胞因子(如IL-17A、IL-17F)是外周炎症的主要驱动因素。(2)二甲双胍的作用差异:在ANTHEM研究中,肥胖和胰岛素抵抗是影响二甲双胍对T细胞炎症作用的重要调节因素。在胰岛素抵抗肥胖个体中,二甲双胍对T细胞的细胞因子谱产生了深远影响,可降低Th17相关细胞因子(如IL-17A、GM-CSF),并激活CD4+ T细胞自噬改善炎症。二甲双胍并未改变胰岛素敏感肥胖个体的CD4+ T细胞产生的细胞因子。
04.二甲双胍与果糖代谢的关联
美国Mark A Herman教授的汇报[4]探究了小肠在果糖代谢中的作用,以及二甲双胍对果糖代谢的影响。肝脏和小肠是果糖代谢的主要场所,给动物注射果糖会诱导严重的胰岛素抵抗和高血压,口服果糖会改变肝脏中三羧酸(TCA)循环代谢物的模式。二甲双胍可改善饮食诱导肥胖小鼠的葡萄糖耐量,减少门静脉葡萄糖水平,减少果糖转化为葡萄糖。二甲双胍还能够减少果糖中碳原子向循环中的TCA循环代谢物的整合。
二甲双胍重塑脑代谢,逆转胰岛素抵抗相关认知衰退
胰岛素抵抗(IR)是阿尔茨海默病及其他痴呆症的重要危险因素。研究表明,二甲双胍可纠正饮食诱导IR所致的脑细胞线粒体功能异常,尤其在胰岛素受体富集的脑区。美国与韩国研究者以壁报[5]形式展示了经过10个月二甲双胍治疗对IR老年人群认知功能、脑网络连接、葡萄糖摄取及区域体积的影响。
研究纳入40例年龄60~80岁的受试者(20男/20女),伴腹型肥胖(BMI≥25 kg/m2 ,腰围男性>102 cm、女性>88 cm),空腹血糖100~125 mg/dl,随机分为二甲双胍组(2500 mg/d)与安慰剂组,干预40周。治疗前后的观察指标包括认知功能(NIH工具箱认知测试)、体积磁共振成像、静息态功能性磁共振成像、脑葡萄糖摄取(18FDG-PET)以及胰岛素敏感性(混合餐耐受性测试,MMTT)。
研究结果
认知功能与脑结构:二甲双胍显著改善工作记忆与处理速度,并减缓杏仁核和海马的体积萎缩,同时增加额叶及颞叶白质体积。
功能连接与代谢优化:IR程度与脑区(尤其额叶-颞叶结构)连接强度呈负相关,二甲双胍可减弱这一负相关性;在前额叶皮质等胰岛素受体富集区域的葡萄糖摄取显著增加,与全身胰岛素敏感性改善一致。
本研究首次在人体证实,二甲双胍可能改善与胰岛素抵抗相关的脑网络连接、脑容量和脑葡萄糖摄取,增强与记忆和其他认知功能相关的脑区的胰岛素敏感性,为认知功能障碍提供了新的治疗靶点(图1)。
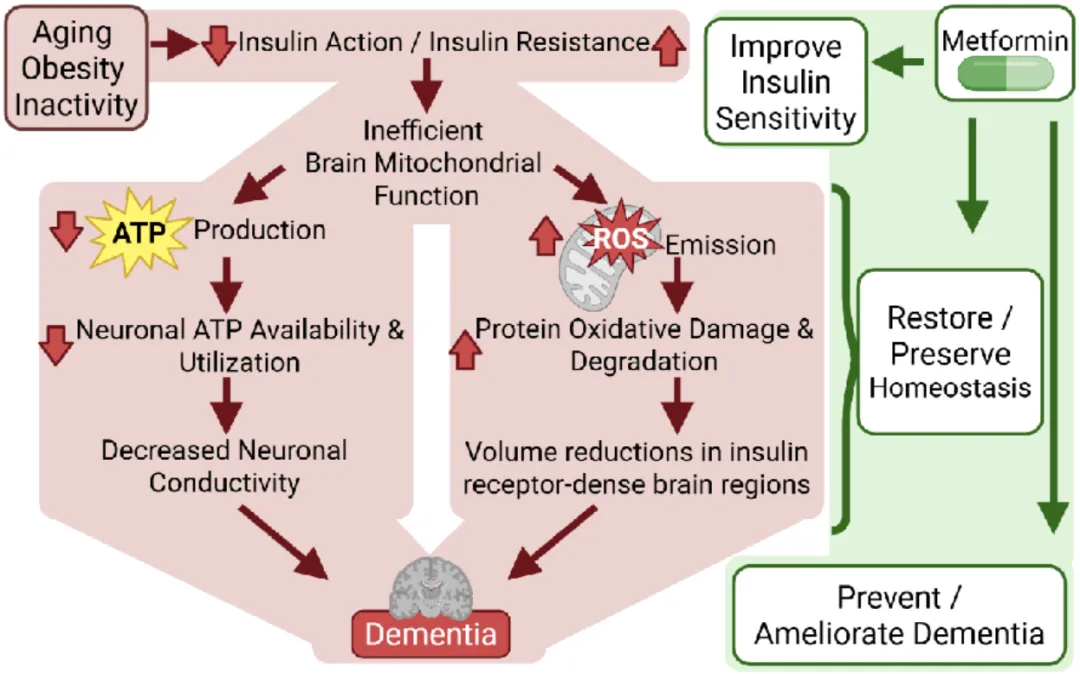
衰老和糖尿病前期会损害胰岛素作用并促进脑胰岛素抵抗,导致线粒体功能障碍,既减少ATP生成(从而损害神经元能量供应和传导),又使活性氧(ROS)释放增加,这会驱动胰岛素受体富集区域发生氧化损伤和体积丢失;这两种情况共同作用可引发痴呆。通过增强胰岛素敏感性,二甲双胍可恢复细胞内能量稳态,可能预防或减轻痴呆。
(注:二甲双胍在中国尚未获批在非T2DM人群中使用)
二甲双胍延缓老年虚弱进程,开启健康老龄化新可能
虚弱是老年人致病和致残的主要原因,而IR是虚弱的重要危险因素。ADA 2025一项美国研究[6],通过随机双盲安慰剂对照试验,探讨了二甲双胍对糖耐量异常老年人群(≥65岁)虚弱的影响。
受试者随机接受24个月二甲双胍治疗(起始500 mg/d,滴定至最大耐受剂量,最大可达2000 mg/d)或安慰剂,并在入组前接受一次饮食和运动咨询。主要终点为基于缺陷累积模型的虚弱指数(frailty index)及Fried标准的虚弱表型来评估虚弱情况,每6个月评估一次。
研究结果
145例受试者被随机分组,141例符合意向性治疗分析集。用药方案为二甲双胍最高2000 mg/d或安慰剂治疗,随访24个月。基线特征显示,48%女性,35%西班牙裔/拉丁裔,平均年龄71.8±5.3岁。 二甲双胍组虚弱指数进展速率较安慰剂组显著降低(-0.0494 ± 0.0216,95%CI:-0.0918 ~ -0.0071,P=0.0222),但Fried标准未显示组间差异(0.0116 ± 0.0077, P=0.1302)。未观察到严重不良事件。
对于糖耐量异常老年人,二甲双胍可能有助于预防虚弱,为延长健康寿命提供了低成本、可行的潜在治疗策略,但不同虚弱评估工具的结果存在差异,未来需进一步明确获益人群与作用窗口期。
(注:二甲双胍在中国尚未获批在非T2DM人群中使用)
专家点评
从分子机制到临床获益,二甲双胍的多靶点作用突破治疗边界
ADA 2025年会上关于二甲双胍的研究突破,进一步拓展了其作为传统降糖药的应用范围。基础研究层面,可以看到大量研究成果,二甲双胍通过抑制线粒体复合物Ⅰ、激活AMPK通路、调节氧化还原状态及肠道果糖代谢等多靶点机制,实现对肝糖异生、炎症反应及能量代谢的精准调控,特别是肝脏和肠道作为药物高浓度聚集部位,相关研究较为充分,但二甲双胍肝外器官靶点的作用还有更多的研究。临床研究的壁报也有诸多亮点,如首次在人体证实,二甲双胍可改善胰岛素抵抗老年人群的脑内网络连接、认知功能并减缓脑结构萎缩,同时在老年糖耐量异常人群中显著延缓虚弱指数进展,为认知衰退和人口老龄化提供了低成本干预策略。这些研究展现了二甲双胍作用机制的复杂性和多样性,在代谢性疾病及年龄相关疾病中“多维度调控-跨器官获益”存在独特价值,为老药新用开辟了更广阔的研究前景与临床转化空间。
专家简介

李益明 教授
复旦大学附属华山医院内分泌科主任,主任医师,教授,博士生导师
中华医学会糖尿病学分会常委、糖尿病神经并发症学组副组长
中国医师协会内分泌代谢科医师分会委员
上海市康复协会糖尿病分会主任委员
上海市医学会内分泌分会副主任委员
上海市中医药学会糖尿病分会副主任委员
上海市中西医结合学会内分泌代谢病专业委员会副主任委员
《中国糖尿病杂志》和《中华糖尿病杂志》编委
《实用内科学》副主编、《harrisen内分泌学》共同主译
主要的研究方向为神经内分泌疾病诊治、糖尿病神经病变和肥胖胰岛素抵抗
参考文献:
1. Benoit Viollet, et al. Metformin and Hepatic Gluconeogenesis. ADA 2025.
2. Navdeep S. Chandel, et al. Metformin targets mitochondrial complex I to improve healthspan. ADA 2025.
3. Barbara Nikolajczyk, el al. The intersection of Metformin and inflammation. ADA 2025.
4. Mark Herman, et al. Metformin and Fructose metabolism. ADA 2025.
5. Ruegsegger G. Metformin Improves Brain Glucose Uptake, Network Connectivity, and Volume Concurrent to Improved Working Memory and Processing Speed in Insulin-Resistant Older Adults. ADA 2025, 879-P.
6. A Two-Year Trial of Metformin to Reduce Frailty in Older Adults with Glucose Intolerance. ADA 2025, 1998-LB.
审批号:CN-MET-00116 有效期到2027年6月24日
2 comments











 京公网安备 11010502033361号
京公网安备 11010502033361号
发布留言