编者按:近年来,新型降糖药物胰高糖素样肽-1受体激动剂(GLP-1RA)的心血管获益备受关注,权威指南也不断强调GLP-1RA在糖尿病合并动脉粥样硬化性心血管疾病(ASCVD)治疗中的一线地位。ASCVD发生发展的核心机制是动脉粥样硬化。研究表明,GLP1-RA可减少2型糖尿病(type 2 diabetes mellitus,T2DM)和高心血管风险患者的动脉粥样硬化事件。那么GLP1-RA是通过何种机制来达到抗动脉粥样硬化作用呢?现进行梳理分析,以飨读者。
证实:CVOT明确GLP-1RA心血管获益
我国T2DM患病率逐年上升,目前已成为全球糖尿病患者人数最多的国家,预计到2045年患病人数将继续增长达1.74亿[1]。心血管疾病(CVD)是我国的首要死亡原因且死亡率仍呈上升趋势[2]。糖尿病合并CVD流行现状严峻,CAPTURE研究结果显示T2DM患者中CVD总体患病率为34.8%,其中85.8%的CVD被归类为ASCVD[3]。而中国亚组分析显示T2DM患者心血管疾病患病率为33.9%,其中,ASCVD占比更高,达94.9%[4]。因此,改善糖尿病患者心血管结局是糖尿病管理关注的焦点。美国食品药品监督管理局规定降糖新药申办方须提供药物心血管安全性证据[5],该项规定进一步提高了糖尿病药物审批标准。新型降糖药的心血管结局试验(CVOT) 结果的发布,不仅提供了新上市降糖药物心血管安全性证据,同时也驱动了糖尿病治疗模式和流程变革。多项针对 GLP-1RA的CVOT结果表明,不同的试验设计、不同的药物暴露时间、不同的人群基线特征可能导致了CVOT结局的差异,其中利拉鲁肽、司美格鲁肽、阿必鲁肽、度拉糖肽、Efpeglenatide均可降低MACE,其他GLP-1RA虽然结局呈中性,但也对心血管结局有改善,总体上证实了GLP-1RA具有多重心血管保护效应[6]。
最新GLP-1RA的CVOT荟萃分析提示:GLP-1RA总体降低MACE风险达14%,总体降低12%全因死亡和11%因心力衰竭入院风险,GLP-1RA在T2DM合并CVD或CVD高危因素时均显示出主要心血管不良事件(MACE)获益[7]。该荟萃分析还显示,对于T2DM患者,无论是合并已确诊的CVD还是仅合并CVD高危因素,GLP-1RA类药物均可降低远期的发生风险,即在T2DM患者中,GLP-1RA类药物对心血管病的二级预防与一级预防有效性一致[7]。对SUSTAIN-6(皮下注射司美格鲁肽)和PIONEER-6(口服司美格鲁肽)研究的事后分析显示,司美格鲁肽综合降低MACE事件风险24%和非致死性卒中风险35%[8]。一项针对卒中影响的荟萃分析显示,GLP‐1RA治疗的T2DM患者卒中总风险降低 16%, 非致死性卒中风险降低15%,而卒中风险降低与糖化血红蛋白 (HbA1c)水平改善或体重下降无关[9]。纳入LEADER 和SUSTAIN 6基线体重指数(BMI)数据的事后分析结果提示GLP-1RA的心血管获益可能不依赖于基线BMI[10]。LEADER研究的事后分析显示,GLP‐1RA的心血管保护作用独立于二甲双胍[11]。
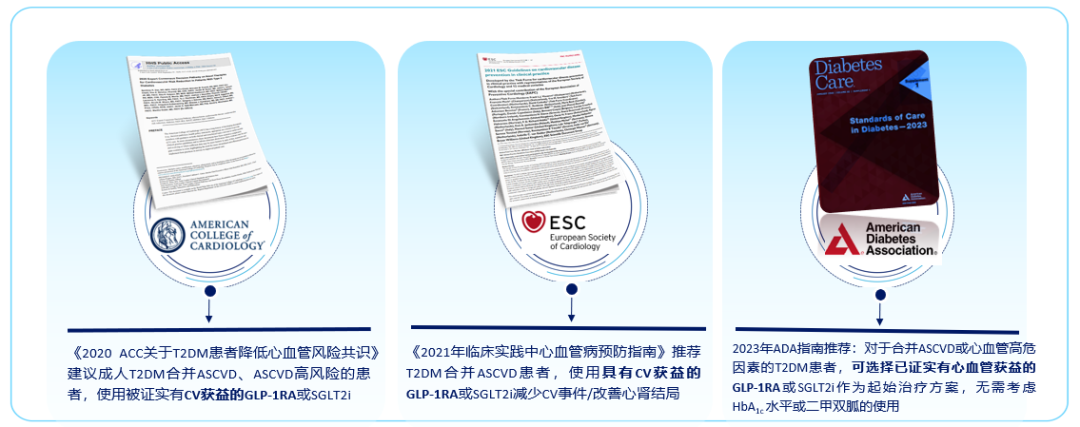
随着GLP-1RA为代表的新型降糖药物CVOT证据的不断积累,糖尿病合并CVD或心血管高风险患者的管理正向着进一步降低MACE风险、降低心血管和全因死亡风险的目标转变。糖尿病相关治疗指南也不断更新,包括2020 ACC关于T2DM患者降低心血管风险共识、2021年临床实践中心血管病预防指南、2023ADA指南、2020年中国T2DM防治指南、2020年中国心血管病一级预防指南、2021年糖尿病合并心血管疾病诊治专家共识、中国成人T2DM合并心肾疾病患者降糖药物临床应用专家共识。糖尿病管理理念不断发展,为T2DM患者ASCVD的防治提供了新理念、新措施。这些指南与共识一致推荐糖尿病合并ASCVD/高危因素患者使用GLP-1RA作为起始治疗方案[12-14],T2DM合并ASCVD使用/优先联合被证实有心血管获益的GLP-1RA[15-18]。(图1)
发现:GLP-1RA调节动脉粥样硬化的危险因素
动脉粥样硬化是ASCVD发病的核心机制,传统因素和新风险因素的累积导致内皮功能障碍和心血管疾病风险增加。 内在因素和环境因素(例如遗传多态性、饮食因素、运动等)会影响内皮抵抗风险因子的能力。衰老、吸烟、糖尿病、高血压、血脂异常、缺乏体力活动、感染/炎症、高同型半胱氨酸和绝经都会导致血管内皮功能障碍,内皮功能障碍会使一氧化氮的产生减少、组织型纤溶酶原激活物降低和黏附因子表达,这些改变导致动脉粥样硬化病变的形成和进展,血栓激活/破裂,由于血栓形成和血管痉挛导致血流量减少,最终导致冠脉事件和卒中[20,21]。(图2)
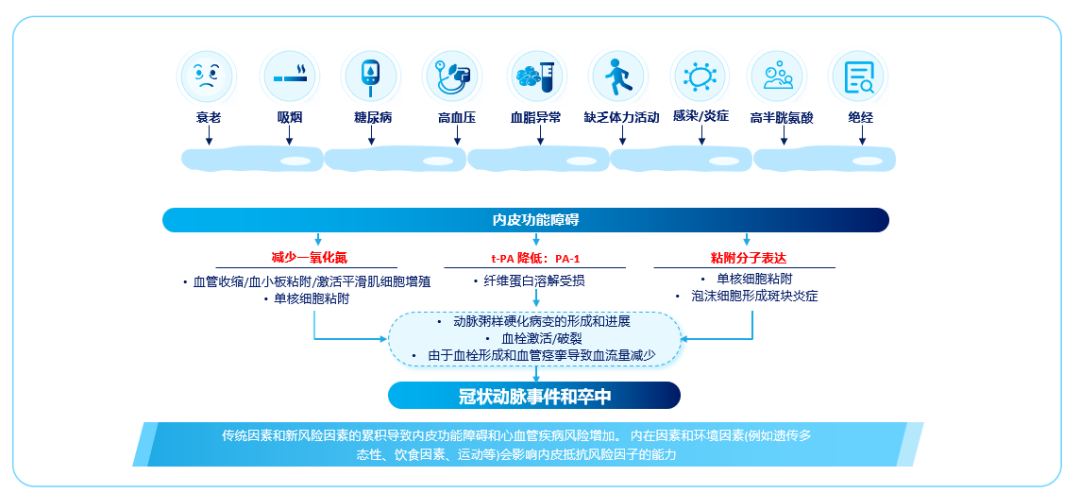
图2. 动脉粥样硬化危险因素及发生发展过程
GLP-1RA可改善血糖、血压、血脂,抑制炎症反应,改善微血管功能,进而减少ASCVD的危险因素,同时通过抑制动脉粥样硬化进展,早期中断事件链,有助于减少终末心血管事件。多项随机对照临床研究结果均显示鲁肽类药物显著改善多种心血管代谢危险因素,包括降低血糖、减轻体重、缩小腰围、降低收缩压、改善血脂等。其中LEADER系列研究证实,利拉鲁肽单药治疗或与其他降糖药物联合治疗均可显著降低T2DM 患者的HbA1c达1.6%,明显减轻体重3.5 kg、减少腰围3.6cm、降低收缩压6.7mmHg及血脂水平[22-33]。此外,临床研究也证实了司美格鲁肽可显著降低T2DM患者的HbA1c达1.8%,明显减轻患者体重6.5kg、减少腰围6.0cm、降低收缩压7.3mmHg及血脂水平[34-43]。(图3)
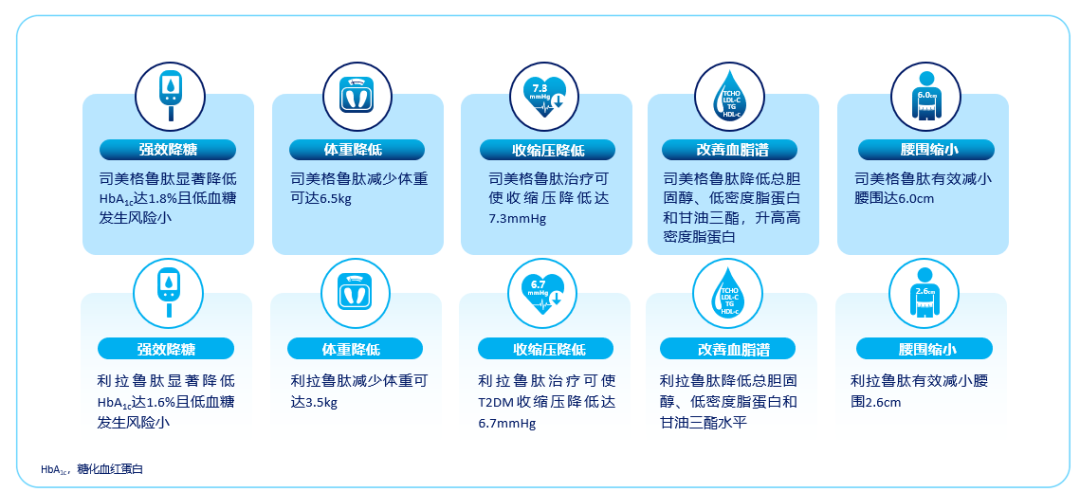
图3. 利拉鲁肽、司美格鲁肽可显著改善多种心血管代谢危险因素
多项真实世界数据亦证实GLP-1RA对多种代谢指标均有显著改善。一项来自意大利的真实世界研究,纳入261例首次起始利拉鲁肽的T2DM患者,其中83.3%应用降压药物,71.2%应用降脂药物,在随访36个月之后,患者的血糖、体重、低密度脂蛋白胆固醇仍均有显著下降。提示利拉鲁肽对多种代谢指标存在好处,且可长期维持[44]。另一项基于加拿大糖尿病注册登记数据库的RWS (SPARE研究),纳入937名未使用过GLP-1RA的成人T2DM患者,旨在探讨接受每周一次司美格鲁肽治疗的血糖控制和体重的短期(3-6个月)变化。结果显示,患者的血糖、体重较基线时均显著降低[45]。同样上述加拿大真实世界研究-SPARE研究显示,患者的血脂、血压较基线时均显著降低[46]。而LEADER研究和SUSTAIN-6研究进一步证实了鲁肽类药物保护肾功能,减少肾脏事件[47,48]。
探索:GLP-1RA抑制动脉粥样硬化的机制
在糖尿病患者的ASCVD防治实践中,孤立地控制单个危险因素是不够的,应重视整体风险的综合管理。而鲁肽类药物显著改善糖尿病患者多种心血管代谢危险因素。ASCVD发病核心机制是动脉粥样硬化。GLP-1RA可通过多机制、多途径抑制动脉粥样硬化斑块形成和进展,包括抑制氧化应激、减少小而密低密度脂蛋白、减少体内巨噬细胞及泡沫细胞、改善内皮功能等[49](图4)。那么,接下来让我们具体梳理一下GLP-1RA心血管获益的可能机制及其循证证据。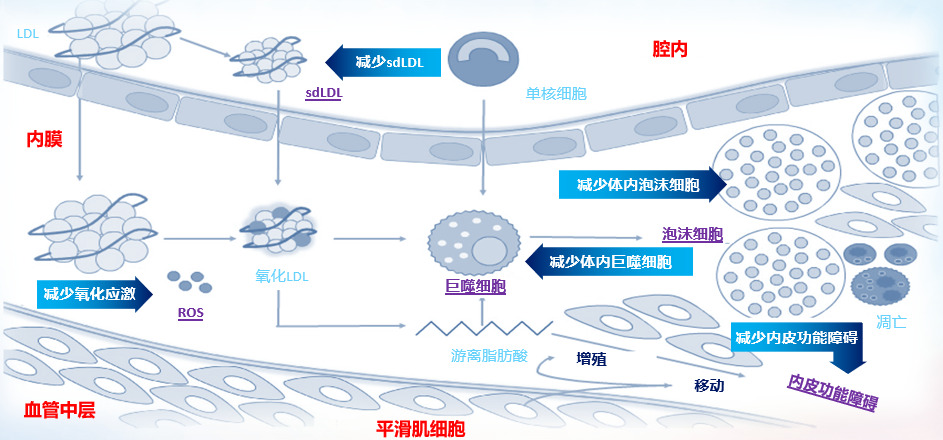
GLP-1RA减少高脂饮食诱导的动脉粥样硬化斑块形成
一项动物研究显示,在ApoE-/-和LDLr-/- 两种小鼠模型中,予WD饮食喂养诱导动脉粥样硬化,并分别予不同剂量司美格鲁肽(4μg/kg、12μg/kg、60μg/kg)及利拉鲁肽(1mg/kg)干预,测定小鼠血浆中总胆固醇和甘油三酯水平,并应用超声显影测定主动脉斑块面积。结果显示:司美格鲁肽和利拉鲁肽干预的两组小鼠的主动脉硬化斑块面积均显著低于对照组[50]。GLP-1RA减少动脉粥样硬化斑块脂质核心及增加纤维帽厚度(稳定斑块)
一项动物研究显示,使用腺病毒载体系统转染ApoE-/-小鼠模型,并给予WD饮食喂养诱导动脉粥样硬化,取小鼠主动脉根部和主动脉弓进行油红染色(Oil-red-O)及天狼猩红染色(PSR)染色观察,GLP-1(7-37)、GLP-1(9-37) 、GLP-1(28-37) 和对照组(每组n=10)组模型中结果显示:GLP-1(7-37)、GLP-1(9-37) 和GLP-1(28-37) 可显著减少小鼠动脉粥样硬化脂质核心并增加纤维帽厚度,达到稳定斑块作用[51]。GLP-1RA下调介导动脉粥样硬化形成的基因
例如胆固醇代谢和脂质介导的信号传导、白细胞慕集、白细胞滚动黏附和外渗、细胞外基质蛋白周转及斑块出血相关基因的表达。[50]。GLP-1RA可减轻氧化LDL(ox-LDL)诱导的血管内皮损伤
ox-LDL诱导的血管内皮细胞损伤是动脉硬化斑块形成的重要步骤。一项在人主动脉内皮细胞中进行的体外研究显示,利拉鲁肽可减轻ox-LDL导致的内皮细胞通透性增加、单核细胞黏附,以及一氧化氮(NO)生成减少,并揭示该类作用可能通过ERK5-KLF2信号通路所实现[52]。(图5)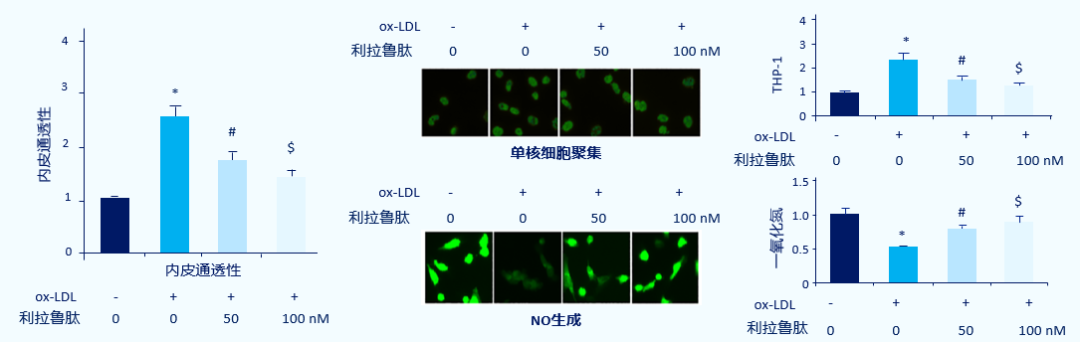
GLP-1RA,胰高糖素样肤-1受体激动剂;THP-1,人髓系白血病单核细胞;*,#,$表示分别与自身前一组相比,p<0.01
GLP-1RA抑制晚期糖基化终末产物(AGE)诱导的冠状动脉平滑肌细胞改变
在糖尿病患者冠脉病变中发现,血管平滑肌细胞存在亚型转换,常表现为从梭状收缩亚型转换为菱形分泌亚型,从而加速冠状动脉粥样硬化。既往研究认为,AGEs在这一过程中起重要作用。一项在大鼠冠状动脉平滑肌细胞中进行的体外研究显示,利拉鲁肽可显著抑制AGEs诱导的冠脉平滑肌细胞形态改变及收缩纤维解离。同时,可减少AGEs诱导的平滑肌细胞来源的I型胶原生成和分泌。上述作用通过抑制NF-κB信号通路及激活PKA信号通路实现[53]。GLP-1RA减轻冠脉支架植入后内膜增生
一项研究采用12只猪作为实验动物,分为糖尿病组、糖尿病+利拉鲁肽组及假手术组,通过注射STZ诱导+高脂饮食形成糖尿病猪模型,3周后进行PCI手术,22周后采用OCT观察新生内膜情况并进一步进行组织学检查。OCT及组织学结果均显示,与糖尿病组相比,糖尿病+利拉鲁肽组动物在冠脉支架植入22周后,拥有更小的新生内膜面积及更大的管腔开放面积。并且显著降低了促炎因子TNF-α及IL-6的浓度,并增加了抗炎因子IL-10浓度[54]。GLP-1RA减轻冠脉支架植入后血管炎症
既往研究显示NLRP3可介导激活IL-1β等促炎因子从而引发血管炎症,而IL-10则通过多种途径起到抗炎保护作用。对冠脉支架植入后的实验动物冠脉内膜内的炎症因子蛋白进行检测,结果显示与糖尿病组相比,糖尿病+利拉鲁肽组实验动物冠脉内膜内的IL-10表达水平显著升高,而NLRP3蛋白表达水平显著降低。研究者进一步通过体外细胞实验对上述发现的可能机制进行了探索,采用THP-1细胞系,结果显示利拉鲁肽可显著抑制高血糖导致的NLRP3过表达,同时增加IL-10蛋白表达,两者均可被GLP-1受体拮抗剂Exe(9-39)所阻断。提示GLP-1RA可通过GLP-1受体进一步调节促炎、抗炎细胞通路,发挥血管保护作用[54]。GLP-1RA减轻LPS诱导的系统性炎性反应
C57BL/6J 小鼠单次注射LPS (0.05 mg/kg)构建急性体内炎症模型,干预组分为两组:分别在LPS注射后1h、4h给予司美格鲁肽 (60 mg/kg),测定血清中炎性细胞因子水平结果显示:与对照组相比,司美格鲁肽4h治疗组,炎性因子水平均显著降低[50]。(图6)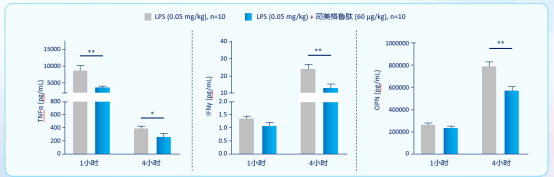
GLP-1RA减轻超敏C反应蛋白介导的系统性炎症
一项事后分析纳入了SUSTAIN3和PIONEER1、2及5研究数据,受试者接受司美格鲁肽皮下注射制剂每周一次给药或口服制剂每周一次给药或对照药物干预,分析评估司美格鲁肽对hsCRP的影响。结果显示,与对照组相比,司美格鲁肽显著降低hsCRP水平[55]。GLP-1RA抑制巨噬细胞(泡沫细胞)形成
ApoE-/-小鼠模型从17周开始分别给予盐水(对照组)和利拉鲁肽(107nmol/kg/天)共4周。对小鼠主动脉进行解剖,测定巨噬细胞及泡沫细胞形成的关键调节因子胆固醇乙酰转移酶1(ACAT1)。结果显示:与对照组相比,利拉鲁肽组可通过下调ACAT1,抑制泡沫细胞形成[56]。GLP-1RA可抑制血小板激活和聚集
一项体外研究采用从健康志愿者体内采集的血小板,将其暴露于native GLP-1(7-36)、GLP-1代谢产物(9-36)及GLP-1类似物利拉鲁肽中,结果显示包括利拉鲁肽在内的所有GLP-1相关肽类均可减少花生四烯酸诱导的血小板激活,以及胶原途径的血小板聚集。这一过程不被GLP-1受体拮抗剂Exendin(9-39)阻断,提示该作用独立于GLP-1受体途径[57]。
总结
动脉粥样硬化是ASCVD的发病核心机制,控制动脉粥样硬化及其危险因素是减少心血管事件和死亡的重要环节。GLP-1RA可改善血糖、血压、血脂、体重等ASCVD危险因素,同时通过抑制动脉粥样硬化进展,早期中断事件链,有助于减少终末心血管事件。多项CVOT试验及真实世界研究证实,包括利拉鲁肽和司美格鲁肽在内的GLP-1RA对心血管具有保护作用,临床应用可早期中断心血管事件链,显著减少终末心血管事件,最终有效改善糖尿病患者的远期结局。专家简介
马建华 教授
二级主任医师,南京医科大学教授,博士生、博士后导师

南京医科大学附属南京医院(南京市第一医院)内分泌科主任,南京市糖尿病防治中心主任
中国初级卫生保健基金会内分泌专委会 主委
中华医学会糖尿病学分会 常委
中国医师协会内分泌代谢科医师分会 委员
中华糖尿病学会β细胞学组 组长
江苏省中西医结合学会内分泌分会 主委
南京医学会内分泌分会 主委
江苏省医学会内分泌分会 候任主委
中华糖尿病杂志、医学研究生学报、国际内分泌代谢杂志、Diabetes中文版编委、Endocrine Reviews中文版编委
南京市中青年行业学科带头人,南京市好市民
参与指南、专家共识编写26部,参编中文专著12部,英文专著1部,中文核心期刊300余篇,SCI收录90余篇

《例鉴真知—糖尿病优质管理工程》火热进行中!
为认真贯彻落实《健康中国 2030》行动,规范中国 T2DM治疗路径,由《中华糖尿病杂志》学术指导,北京健康促进会联合多家医疗机构在2023年发起“例鉴真知一糖尿病优质管理工程”项目,旨在提升广大医生对指南的理解认知,推动医生遵循指南规范临床诊疗路径,落实糖尿病综合管理,提升患者综合获益。2023 例鉴真知敬请关注并期待您的参与!
参考文献
1. 中国心血管代谢联盟. 中华心血管病杂志(网络版)2023,6: e1000139(20230516).
2. 霍勇.中国介入心脏病学杂志,2021,29(03):124-126.
3. Mosenzon O, et al. Abstract 158. Presented at the 56th Annual Meeting of th European Association of the Study of Diabetes, Macrovascular complications and beyond, 10:15 CDT on 24 September 2020.
4. Hong Tianpei, et al. CAPTURE. GW-ICC 2020 Poster: GW31–e1199
5. U.S. Food and Drug Administration. Guidance for industry: diabetes mellitus-evaluating cardiovascular risk in new antidiabetic therapies to treat type 2 diabetes. 2008. https://www.regulations.gov/ document?D=FDA-2008-D-0118-0028. [2008.12.19] [2020.5.8].
6. 肖诚,等.中华糖尿病杂志.2022;14(12):1348-1354
7. Sattar N et al. Lancet Diabetes Endocrinol. 2021; S2213-8587(21)00203-5.
8. Husain M,et al.Diabetes Obes Metab, 2020, 22(3): 442‐451
9. Bellastella G, et al. Stroke, 2020, 51(2): 666‐669.
10. Verma S, et al. Diabetes Obes Metab. 2020 Nov;22(11):2193-2198.
11. Crowley MJ, et al. Diabetes Care. 2020 Sep;43(9):e108-e110.
12. Cosentino F, et al. European Heart Journal (2020) 41, 255-323.
13. Visseren, FLJ, et al. European Heart Journal (2021) 42, 32273337.
14. ADA. Diabetes Care. 2023;46(Suppl.1):S1–S291
15. 中华医学会心血管病学分会,中华心血管病杂志.2020,12 (48) :1000-1038.
16. 国家卫生健康委员会能力建设和继续教育中心,中华内科杂志.2021 ,60(5):421-437.
17. 中国成人2型糖尿病合并心肾疾病患者降糖药物临床应用专家共识.中华糖尿病杂志, 2020, 12(6): 369‐381.
18. 中国2型糖尿病防治指南.2020年版.中华糖尿病杂志.2021;13(4):315-409.
19. Victor J, et al. Circulation. 2006;114: 2850-2870.
20. Katharina Lechner, et al. Eur J Prev Cardiol.2020 Mar;27(4):394-406.
21. Joseph A. et al. Circulation Olume, 2002, 106(2):164-166.
22. Marre et al. Diabet Med 2009;26;268–278. (LEAD-1).;
23. Nauck et al. Diabetes Care 2009;32;84–90 .(LEAD-2).;
24. Garber et al. Lancet 2009;373:473–481. (LEAD-3).;
25. Zinman et al. Diabetes Care 2009;32:1224–1230. (LEAD-4).;
26. Russell-Jones et al. Diabetologia 2009;52:2046–2055 .(LEAD-5).;
27. Buse et al. Lancet 2009;374:39–47. (LEAD-6)
28. Pratley et al. Lancet. 2010:375;1447–1456.
29. Fonseca VA et al. International Diabetes Federation 21st World Diabetes Congress, 4–8 December 2011, Dubai, UAE.
30. Marso SP et al. N Engl J Med. 2016 Jul 28; 375(4): 311–322.
31. Liakos A, et al. Diabetes Obes Metab. 2019 Mar;21(3):517-524.
32. Richard E Pratley, Lancet. 2010 Apr 24;375(9724):1447-56. 33. Dalsgaard NB et al. Diabetes Obes Metab 2018;20:508–519.
34. Sorli C et al. Lancet Diabetes Endocrinol 2017;5:251–60;
35. Ahrén B et al. Lancet Diabetes Endocrinol 2017;5:341–54;
36. Ahmann AJ et al. Diabetes Care 2018;41:258–66;
37. Aroda VR et al. Lancet Diabetes Endocrinol 2017;5:355–66;
38. Rodbard HW et al. J Clin Endocrinol Metab 2018;103:2291–301;
39. Pratley RE et al. Lancet Diabetes Endocrinol 2018;6:275–86;
40. Lingvay I et al. Lancet Diabetes Endocrinol. 2019 Nov;7(11):834-844.
41. Zinman B et al. Lancet Diabetes Endocrinol 2019;7:356–67;
42. Capehorn MS et al. Diabetes Metab. 2019 Sep 10 12 ;
43. Pratley RE et al. Lancet Diabetes Endocrinol 2018;6:275–86;
44. Maurizio Rondinelli, et al. Clin Ther. 2017;39:159–169
45. Brown RE et al. Diabetes Obes Metab 2020;22:2013‒20
46. Brown RE et al. Diabetes Obes Metab 2020;22:2013‒20.
47. Lancet Diabetes Endocrinol. 2020 Nov;8(11):880-893.
48. Mann JFE, et al., N Engl J Med 2017;377:839-48
49. Rizzo M, et al. Biochim Biophys Acta Mol Basis Dis. 2018;1864:2814-2821.
50. Günaj Rakipovski, et al. JACC Basic Transl Sci. 2018 Nov 21;3(6):844-857
51. Burgmaier M, et al. Atherosclerosis. 2013 Dec;231(10):427-435
52. Wen Yue, et al. IUBMB Life. 201;71(9):1347-1354
53. Beibing Di, et al. Peptides. 2019;112:125–132
54. Jinggang Xia, et al. Front Pharmacol. 2020;11:372
55. 来自2021 EASD POSTER
56. Yuko Tashiroa, et al. Peptides. 2014 Apr;54:19-26
57. Cristina Barale, et al. Thromb Haemost. 2017;117:1115–1128










 京公网安备 11010502033361号
京公网安备 11010502033361号
发布留言