编者按:糖尿病是心血管疾病(CVD)最重要的合并疾病,CVD是2型糖尿病(T2DM)患者致死致残的主要原因。T2DM患者存在的胰岛素抵抗、高血糖、脂代谢紊乱、腹型肥胖及高凝状态均是引发CVD的危险因素。CVD各种危险因素均可作用于动脉内膜,导致内皮细胞功能障碍,由此引发动脉粥样硬化发生。糖尿病患者往往动脉粥样硬化性心血管疾病(ASCVD)病变弥漫严重,预后差。因此,预防和治疗ASCVD及其危险因素、降低大血管并发症风险应成为T2DM患者综合管理的主要目标之一。
T2DM合并CVD是巨大的临床挑战
我国T2DM的患病率逐年上升,目前我国18岁以上成人糖尿病患病率达12.8%、患病人口达1.298亿[1]。而T2DM合并CVD的情况非常普遍,已经成为糖尿病管理的一个巨大挑战。糖尿病与CVD密切相关,糖尿病患者的多种风险因素(高血压、高血糖、胰岛素作用受损、血脂异常、肥胖)引起CVD加速发生发展。糖尿病患者的CVD主要包括ASCVD和心力衰竭,其中ASCVD主要包括冠心病、脑血管疾病[2]。我国33.9%的T2DM患者患有CVD,其中94.9%患有ASCVD,这一比例远高于全球水平[3]。2021年《中国心血管健康与疾病报告》指出[4],我国CVD患病率处于持续上升阶段,在人口老龄化和代谢危险因素持续流行的双重压力下,CVD负担仍将持续增加,这对我国CVD防治策略和医疗资源配置提出了新的需求。据推算,我国CVD现患人数高达3.3亿。2019年农村、城市CVD分别占死因的46.74%和44.26%,每5例死亡中就有2例死于CVD,卒中和缺血性心脏病在我国单病种死因中排列第一位和第二位(图1)。农村CVD死亡率从2009年起超过并持续高于城市水平。2019年冠心病死亡率继续2012年以来的上升趋势,农村地区上升明显,到2016年已超过城市水平(图2)。中国慢性病前瞻性研究(CKB)结果显示,与非糖尿病人群相比,糖尿病患者的全死因死亡率显著增加,农村地区高于城市地区,其中CVD是糖尿病患者的首要死因[5];糖尿病使缺血性心脏病风险增加至2.18~2.67倍,使卒中风险增加至1.6~1.78倍[6];该研究同时也发现我国糖尿病人群冠心病及卒中相关死亡风险加倍[5]。由此可见,CVD防控形势非常严峻。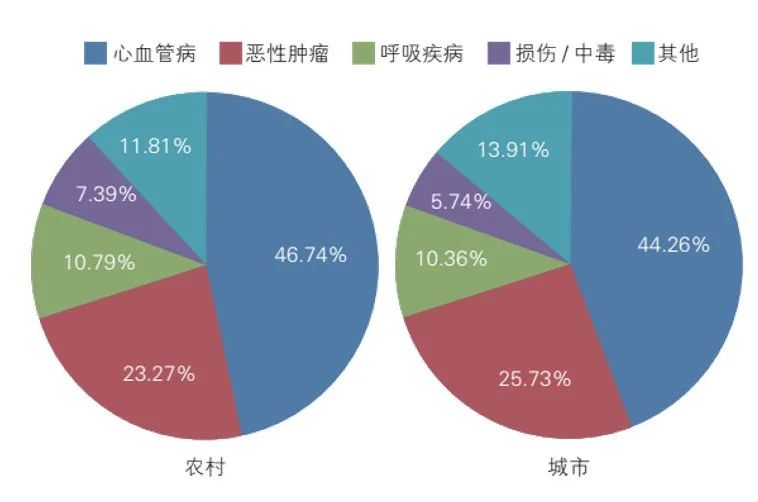
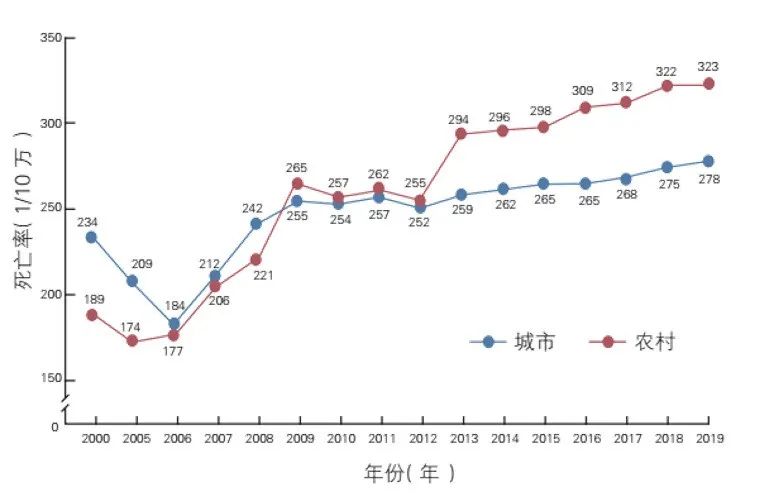
图2. 2000~2019年中国城乡居民心血管病死亡率变化
T2DM患者心血管危险因素管理目标与策略
T2DM是一种复杂的疾病,其心血管事件的发生风险是非糖尿病者的2~4倍[7],约半数糖尿病患者死于CVD[8]。心血管风险已经成为T2DM管理中的重要问题,需要持续的医疗服务和全面的多策略管理才能降低CVD风险。糖尿病患者通常并存高血压、血脂紊乱、肥胖等多项心血管危险因素,合并心血管危险因素越多,心血管事件危险性倍增[9]。对多重危险因素的综合干预可显著改善糖尿病患者CVD的发生和死亡风险[10]。因此,对T2DM个体全面评估ASCVD危险程度,有助于制定个体化的干预目标,并通过院内院外长期有效的管理,控制糖尿病患者心血管危险因素于靶目标下,以最大限度降低心血管风险。血压管理
高血压是导致我国居民CVD发病和死亡的首要危险因素,约50%的CVD发病和20%的心血管死亡归因于高血压[11]。全国性CCMR-3B研究显示,我国T2DM患者中六成合并高血压[12]。然而,合并高血压的糖尿病患者中只有76.9%接受抗高血压药治疗,其中仅有17.5%血压达标[12]。高血压作为CVD的独立危险因素,其控制情况直接影响到CVD的发生。因此,积极防控高血压是改善T2DM患者心血管预后的重要措施之一。高血压合并糖尿病导致的冠心病/卒中风险显著增加。中国城乡流行病学前瞻性研究显示:糖尿病患者中,高血压与冠心病和卒中风险增加相关;糖尿病组中自我报告冠心病患病率为:正常血压(<120/80 mmHg)5.4%,正常高值血压(≥120/80 mmHg)6.7%,高血压(≥140/90 mmHg)13.3%;糖尿病组中自我报告卒中患病率为:正常血压(<120/80 mmHg)1.7%,正常高值血压(≥120/80 mmHg)1.7%,高血压(≥140/90 mmHg)6.4%[13]。由此可见,控制高血压可显著降低糖尿病并发症和心血管事件的发生风险,收缩压每下降10 mmHg,死亡风险下降13%,并减少大血管及微血管病变风险[14]。
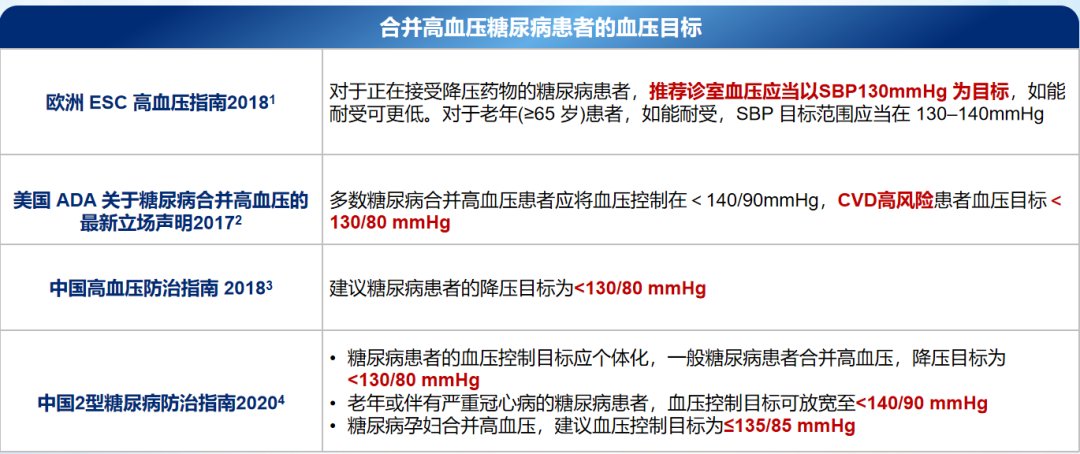
中国、欧洲、美国的高血压相关指南对糖尿病合并高血压患者的血压目标给出了明确推荐(表1),大多建议血压控制目标为<130/80 mmHg[2,15-17]。为了实现血压达标,糖尿病合并高血压患者的降压药物该如何选择?《中国T2DM防治指南2020》推荐[2]:糖尿病患者的血压≥140/90 mmHg时可考虑开始降压药物治疗,血压≥160/100 mmHg或高于目标值20/10 mmHg时应立即开始降压药物治疗,并应用联合治疗方案;五类降压药物均可用于糖尿病合并高血压患者:血管紧张素转化酶抑制剂(ACEI)、血管紧张素Ⅱ受体拮抗剂(ARB)、钙通道阻滞剂、利尿剂、选择性β受体阻滞剂;优选长效制剂平稳控制24小时血压,ACEI或ARB在糖尿病合并白蛋白尿或慢性肾脏病时为首选,联合用药可以ACEI或ARB为基础,联合钙通道阻滞剂、小剂量利尿剂或选择性β受体阻滞剂,联合方案更推荐单片固定复方制剂(ARB/钙通道阻滞剂、ARB或ACEI/利尿剂)。
血脂管理
T2DM患者血脂异常的发生率明显高于非糖尿病患者[18]。T2DM患者合并血脂异常,可进一步增加大血管和微血管并发症的风险[7]。血脂异常是T2DM患者ASCVD发生率增加的重要危险因素[19,20]。因此,严格控制血脂是CVD的一个重要治疗目标。T2DM患者的血脂异常特点表现为血清甘油三酯(TG)、极低密度脂蛋白、游离脂肪酸水平升高,高密度脂蛋白胆固醇(HDL-C)水平下降,持续性餐后高脂血症以及低密度脂蛋白胆固醇(LDL-C)水平轻度升高,小而密的低密度脂蛋白和小而密的高密度脂蛋白均增加[2]。这些血脂异常是引起糖尿病血管病变的重要危险因素。CCMR-3B研究对全国104家医院的25817例中国T2DM门诊患者进行了调查,结果发现42%的T2DM患者合并血脂异常,其中仅有55%的患者接受了调脂治疗[7]。此外,该研究中血脂四项指标均达标的患者比例仅为12%,总胆固醇(TC)达标率仅为36%[7]。
血脂异常是T2DM患者发生致死/非致死性心肌梗死的重要危险因素[21]。LDL-C水平每降低1 mmol/L(38.7mg/dL),主要心血管事件风险降低23%[22]。心血管危险分层:(1)高危:无ASCVD的糖尿病患者;(2)极高危:有明确ASCVD病史的糖尿病患者。ASCVD病史包括既往心肌梗死或不稳定型心绞痛、稳定型心绞痛、冠状动脉血运重建术后、卒中和短暂性脑缺血发作以及外周动脉疾病。进行调脂药物治疗时,推荐将降低LDL-C作为治疗目标。依据患者ASCVD风险等级,推荐将LDL-C和非HDL-C降至目标值(图3)[2]。

合并血脂异常糖尿病患者的调脂药物如何选择?《中国T2DM防治指南2020》推荐[2]:起始宜应用中等强度他汀,根据个体调脂疗效和耐受情况,适当调整剂量。若胆固醇水平不能达标,与其他调脂药物联合使用(如依折麦布),针对极高危患者若他汀联合依折麦布4~6周后仍不达标,可加用前蛋白转化酶枯草溶菌素/kexin 9型抑制剂,以获得安全有效的调脂效果,进一步降低心血管风险。近年有报道发现他汀类药物增加糖尿病发病风险,但他汀类药物降低心血管事件的获益大于糖尿病发病风险的增加,仍推荐使用。如果LDL-C基线值较高,现有调脂药物标准治疗3个月后,难以使LDL-C降至所需目标值,则可考虑将LDL-C至少降低50%以上作为替代目标。基线是指未接受降脂药物治疗时的LDL-C水平,而正在接受降脂治疗的患者中,则外推计算基线的LDL-C水平。LDL-C达标后,若TG水平仍高,可在他汀治疗的基础上加用降低TG药物(如贝特类)。如果空腹TG≥5.7 mmol/L,为预防急性胰腺炎,应首先使用降低TG的药物。
抗血小板治疗
近年来关于阿司匹林在ASCVD一级预防中的作用一直争议不断。2018年公布了三项关于阿司匹林一级预防的大型安慰剂对照随机临床试验—ARRIVE研究、ASPREE研究和ASCEND研究,这三项试验质疑阿司匹林一级预防的净获益[23-25]。目前,一级预防用于糖尿病合并ASCVD高危患者的适应证为年龄≥50岁而且合并至少1项主要危险因素(早发ASCVD家族史、高血压、血脂异常、吸烟或慢性肾脏病/蛋白尿),无出血高风险[26]。除了在少数心血管风险显著增高且出血风险较低的人群中可以谨慎考虑应用阿司匹林,一般不建议未确诊ASCVD的患者应用阿司匹林进行一级预防。有效的二级预防是减少CVD复发与死亡、提高CVD患者生存质量的重要手段。阿司匹林对心血管事件二级预防的有效性已有共识。糖尿病患者合并ASCVD需应用阿司匹林作为二级预防,同时需要充分评估出血风险;小剂量阿司匹林仅对体重不足70 kg的患者(伴或不伴有糖尿病)有效,而对于体重≥70 kg的患者则需更高剂量的阿司匹林[27],对于糖尿病患者阿司匹林的给药方式及给药剂量仍需进一步研究;推荐阿司匹林剂量:75~150 mg/d[2]。
糖尿病合并ASCVD患者P2Y12受体拮抗剂应用指征:阿司匹林过敏的ASCVD患者,需应用氯吡格雷(75 mg/d)作为二级预防[26]。急性冠脉综合征患者需应用1种P2Y12受体拮抗剂与阿司匹林联用至少1年,获益可能更多。证据支持非经皮冠状动脉介入治疗患者应用替格瑞洛或氯吡格雷或普拉格雷。糖尿病合并心肌梗死史患者,替格瑞洛加阿司匹林可以显著减低缺血性事件包括CVD和冠心病死亡[28]。
GLP-1RA在T2DM合并CVD及风险因素管理中的作用
随着对T2DM病理生理变化认识不断提高,新的血糖控制指标不断涌现,新型降糖药的广泛应用,糖尿病大血管并发症防治理念也随着大型循证研究结果的发布迭代更新。众所周知,UKPDS研究分析显示,高血糖与糖尿病并发症风险之间存在密切关系。HbA1c水平降低可能显著减少糖尿病并发症的发病风险,HbA1c每下降1%,可使心肌梗死风险下降14%,卒中风险下降12%,心力衰竭风险下降16%[29]。自2013年开始陆续揭晓的多种新型降糖药物的心血管结局研究(CVOT)结果更是进一步推动了CVD治疗理念以及模式流程的变革。胰高血糖素样肽受体激动剂(GLP-1RA)心血管安全性评估(ELIXA研究、LEADER研究、SUSTAIN-6研究、EXSCEL研究、PIONEER-6研究、HARMONY OUTCOMES研究、REWIND研究)结果显示,除利司那肽、艾塞那肽外,利拉鲁肽、度拉糖肽、阿必鲁肽和司美格鲁肽在减少主要心血管不良事件(3P-MACE,包括心血管死亡、非致死性心肌梗死和非致死性卒中)发生风险中均存在显著优势[30-36]。例如LEADER研究显示,利拉鲁肽的应用可显著降低3P-MACE发生风险13%,降低心血管死亡风险22%,同时降低全因死亡风险15%[31];SUSTAIN-6研究显示,司美格鲁肽大大降低MACE发生风险高达26%,且该效应长期持续;对MACE的3个组分进一步分析,发现司美格鲁肽也能显著降低非致死性卒中的发生风险达39%,提示其降低MACE风险主要来自于非致死性卒中的驱动[32]。基于SUSTAIN-6的研究结果,美国食品药品监督管理局(FDA)正式批准了司美格鲁肽的心血管适应证,即用于T2DM合并已确诊CVD的患者,以降低MACE风险。2021年4月27日,我国国家药品监督管理局也批准了司美格鲁肽注射液的心血管适应证,即适用于降低伴有CVD的T2DM成人患者的MACE风险,成为中国首个且唯一具有心血管适应证的GLP-1RA周制剂。
一项纳入LEADER、SUSTAIN-6和PIONEER-6研究人群的荟萃分析进一步证明GLP-1RA类药物对MACE的影响,认为GLP-1RA可作为患有或未患有T2DM患者的心血管和脑血管疾病的一级或二级预防[37]。一项纳入8项GLP-1RA的CVOT荟萃分析显示GLP-1RA使MACE风险下降14%,心血管死亡风险下降13%,致死/非致死性心肌梗死风险下降10%,致死/非致死性卒中风险下降17%[38]。另一项纳入7个GLP-1RA CVOT研究的网状Meta分析显示,司美格鲁肽周制剂显著降低T2DM卒中风险可能达59%,在降低卒中风险排名第一[39]。
值得注意的是,利拉鲁肽除了降糖、心肾保护作用外,还具有多重代谢获益,利拉鲁肽治疗可以使体重降幅最高达3.7kg,收缩压降低最高达6.7mmHg,同时还可以改善血脂谱,降低TC、LDL和TG水平[40-50]。SUSTAIN系列研究结果显示:司美格鲁肽治疗可使体重降幅最高达6.5kg,收缩压降幅最高达7.3mmHg,司美格鲁肽治疗同样可以改善血脂谱[51]。选择兼具降糖及多个代谢相关指标获益的GLP-1RA,将改善T2DM患者的多重心血管结局、有效降低ASCVD发生率和致死率。
随着循证证据的积累,GLP-1RA类药物的作用备受肯定,推荐地位在国内外各大指南中稳步提升。2019年欧洲心脏病学会/欧洲糖尿病研究协会(ESC/EASD)指南以及2020年ADA指南提出,不论HbA1c是否达标,在确诊ASCVD或ASCVD高风险的T2DM患者中推荐直接起始或者优先使用有心血管获益的GLP-1RA或钠-葡萄糖共转运蛋白2抑制剂(SGLT2i)[52,53],这提示糖尿病大血管并发症防治理念向“控制血糖与改善心血管事件和死亡结局并重”的综合管理预防模式转变。2021年糖尿病患者合并CVD诊治专家共识推荐:若二甲双胍存在禁忌证或不耐受,建议具有心血管保护证据的GLP-1RA或SGLT2i作为T2DM合并CVD患者一线降糖药物[54]。2022年ADA/EASD共识取消了二甲双胍的一线地位,建议伴ASCVD/高风险因素人群使用具有心血管获益的GLP-1RA。其中伴ASCVD/高风险因素人群建议使用具有心血管获益的GLP-1RA或SGLT2i;伴CKD患者的降糖治疗指南推荐SGLT2i和GLP-1RA;以降糖和减重为目标的人群建议使用超强效至强效、具有降糖减重双重疗效的药物[55]。
GLP-1RA引领了糖尿病管理从血糖管理到整体化管理的治疗理念改变,更成为国内外指南一致推荐的ASCVD合并T2DM全程治疗的一线药物。推动糖尿病患者进行以降低心血管事件为目的的降糖治疗,积极引导包括GLP-1RA、SGLT2i等新型降糖药的应用,有助于减缓我国心血管事件进展,进而减少全人群的CVD发病率和死亡率。
总结
我国每5例死亡中就有2例死于CVD,CVD也是我国糖尿病患者的首要死因。糖尿病是CVD的独立危险因素,糖尿病患者常常合并高血压、血脂紊乱等CVD的重要危险因素,使CVD的风险显著增加,对包括高血压、血脂紊乱、高血糖等多重危险因素的综合控制可显著改善糖尿病患者心脑血管疾病和死亡风险。不断涌现的新型降糖药物CVOT结果推动了CVD治疗理念以及模式流程的变革,2022年ADA/EASD共识建议伴ASCVD/高风险因素人群使用具有心血管获益的GLP-1RA或SGLT2i;GLP-1RA在临床研究中显示出明确的心血管获益,并可改善血压、体重和血脂谱,GLP-1RA在T2DM合并CVD及风险因素管理中发挥着重要的作用。专家简介
赵维纲 教授
北京协和医院内分泌科,主任医师

北京协和医院医疗委员会委员
北京协和医学院 ,博士生导师
中华临床营养杂志总编辑;北京医学杂志副总编
健康中国研究中心糖尿病防治及管理专家委员会主任委员
中国老年保健医学研究会老年内分泌与代谢分会 副主委
中国老年学学会内分泌代谢分会 常委;
自1990年于北京协和医院内分泌科工作至今。1995至1996年留学法国
以课题负责人承担十三五科技重大专项、北京市科委、北京市自然基金,以课题副组长承担了国家十一五、十二五科技重大专项、国家卫生计生委公益性行业科研专项等多项课题
参考文献
1.Li Y, et al. BMJ. 2020 Apr 28;369:m997.
2.中华医学会糖尿病学分会.中华糖尿病杂志,2021,13(4):315-409.
3.中国心血管健康与疾病报告编写组.中国心血管健康与疾病报告2021概要[J].中国循环杂志,2022,37(6):553-578.
4.Hong Tianpe,et al. CAPTURE. GW-ICC 2020 Poster: GW31–e1199.
5.Bragg F, et al. JAMA. 2017 Jana 17;317(3):280-289.
6.Bragg F, et al.PLoS Med. 2016;13(7):e1002026.
7.Ji L , et al. American Journal of Medicine. 2013;126(10):925.e11-925.e22.
8.Campbell P T , et al. Diabetes Care. 2012;35(9):1835-1844.
9.Kannel WB.Am J Hypertens. 2000;13(1 Pt 2):3S-10S.
10.Gaede P, et al. N Engl J Med. 2008;358(6):580-591.
11.HEJ,et al. Lancet.2009;374(9703):1765-1772
12.Zhang YQ, et al.J Clin Hypertens (Greenwich). 2019 Nov;21(11):1654-1663.
13.Zhang Y, et al. J Hypertens. 2018 Jan;36(1):93-100.
14.Emdin CA, et al.JAMA. 2015 Feb 10;313(6):603-15.
15.European Heart Journal(2018)00,1–98
16.de Boer IH, et al.Diabetes Care. 2017;40:1273–1284 .
17.中国高血压防治指南修订委员会,等.中国心血管杂志,2019,24(1):24-56.
18.Cui R,et al.Clin Interv Aging. 2016;11:445-452.
19.Mottillo S,et al.J Am Coll Cardiol. 2010;56(14):1113-1132.
20.Fox CS, et al.JAMA. 2004;292(20):2495-2499.
21.Turner RC,et al. BMJ. 1998 Mar 14;316(7134):823-828.
22.Silverman MG, et al. JAMA. 2016 Sep 27; 316(12):1289-1297
23.ASCEND Study Collaborative Group.N Engl J Med. 2018 Oct 18;379(16):1529-1539.
24..J Michael Gaziano,et al. Lancet. 2018 Sep 22;392(10152):1036-1046.
25.John J McNeil,et al.N Engl J Med. 2018Oct 18;379(16):1509-1518.
26.American Diabetes Association.Diabetes Care. 2020, 43 Suppl 1:S111-S134.
27.Rothwell PM, et al. Lancet. 2018;392(10145): 387-399.
28.Bhatt DL, et al. J Am Coll Cardiol, 2016;67(23): 2732-2740.
29.Stratton IM, et al. BMJ. 2000 Aug 12;321(7258):405-412.
30.Pfeffer MA,et al. N Engl J Med. 2015;373(23):2247‐2257.
31.Marso SP, et al.N Engl J Med. 2016;375(4):311‐322.
32.Marso SP,et al. N Engl J Med. 2016;375(19):1834‐1844.
33.Holman RR, et al. N Engl J Med. 2017;377(13):1228‐1239.
34.Husain M, et al. N Engl J Med. 2019;381(9):841‐851.
35.Hernandez AF, et al. Lancet. 2018;392(10157):1519‐1529.
36.Gerstein HC, et al.Lancet. 2019;394(10193):121‐130.
37.Iqbal AM,et al. Curr Drug Saf. 2021;16(2):197-206.
38.Sattar N, et al. Lancet Diabetes Endocrinol. 2021 Oct;9(10):653-662.
39.Alfayez OM, et al. Cardiovasc Diabeto. 2020;19(1):96.
40.Marre et al. Diabet Med. 2009;26;268–278.
41.Nauck et al. Diabetes Care. 2009;32;84–90.
42.Garber et al. Lancet. 2009;373:473–481.
43.Zinman et al. Diabetes Care. 2009;32:1224–1230.
44.Russell-Jones et al. Diabetologia. 2009;52:2046–2055.
45.Buse et al. Lancet. 2009;374:39–47.
46.Pratley et al. Lancet. 2010:375;1447–1456.
47.Pratley R, et al. Int J Clin Pract. 2011 Apr;65(4):397-407.
48. Fonseca VA et al. International Diabetes Federation 21st World Diabetes Congress, 4-8 December 2011, Dubai, UAE.
49.Liakos A, et al. Diabetes Obes Metab. 2019 Mar;21(3):517-524.
50.Dalsgaard NB et al. Diabetes Obes Metab. 2018;20:508–519
51.Diabetes & Metabolism 45 (2019):409–418
52.Cosentino F, et al.Eur Heart J. 2020 Jan 7;41(2):255-323.
53.American Diabetes Association. Diabetes Care. 2020 Jan;43(Suppl 1):S98-S110.
54. 孙艺红,等.中华内科志,2021,60(5):421-437.
55.Davies MJ, et al.Diabetes Care. 2022 Nov 1;45(11):2753-2786.










 京公网安备 11010502033361号
京公网安备 11010502033361号
发布留言