编者按
二甲双胍临床应用逾六十载,是2型糖尿病(T2DM)治疗的基石药物,改善了全球糖尿病患者的健康状况。正在奥地利维也纳举办的第61届欧洲糖尿病研究协会年会(EASD 2025)上,一场“二甲双胍与糖尿病的未来”的专题研讨会备受关注。来自美国西奈山伊坎医学院Jeffrey Mechanick教授,与哥伦比亚大学欧文医学中心Jose Luchsinger教授及阿联酋穆罕默德·本·拉希德大学Mohamed Hassanein教授分别从全球糖尿病早期干预、认知保护及体重维持三大维度[1-3]分享最新见解,为糖尿病治疗的未来揭示了兼具全球视野与循证指导的二甲双胍应用新潜力。本刊特邀华中科技大学同济医学院附属同济医院余学锋教授进行详细介绍。

一、跨文化适配:二甲双胍仍是全球糖尿病管理的核心选择
全球糖尿病正面临疾病负担高与异质性高的双重挑战。2024年全球糖尿病患者人数已达5.887亿,预计到2050年将增至8.525亿[4]。糖尿病常与肥胖、高血压及血脂异常形成共病网络,而不同地区在饮食习惯、经济发展水平和医疗资源可及性方面差异显著,采用“统一化”管理难以普遍适用。因此,明确二甲双胍在跨文化背景下的核心定位显得尤为重要。
1、tCMBCD模型提示共病管理需考虑社会环境对心血管代谢疾病的影响
为整合多疾病风险,研究者提出了一个三维、跨文化、心血管代谢慢性疾病(tCMBCD)模型,涵盖肥胖相关疾病(ABCD)、血糖异常相关疾病(DBCD)、高血压相关疾病(HBCD)、血脂异常相关疾病(LBCD)[5]。研究表明,社会因素显著影响心血管代谢疾病关联:在区域剥夺指数(ADI)较高地区(ADI分数越高,表示社会经济条件越差),ABCD与DBCD的相关性(r=0.32)远低于ADI较低地区(r=0.61,P=0.012)(图1)。这一结果提示,跨文化管理需优先考量社会环境差异[5]。
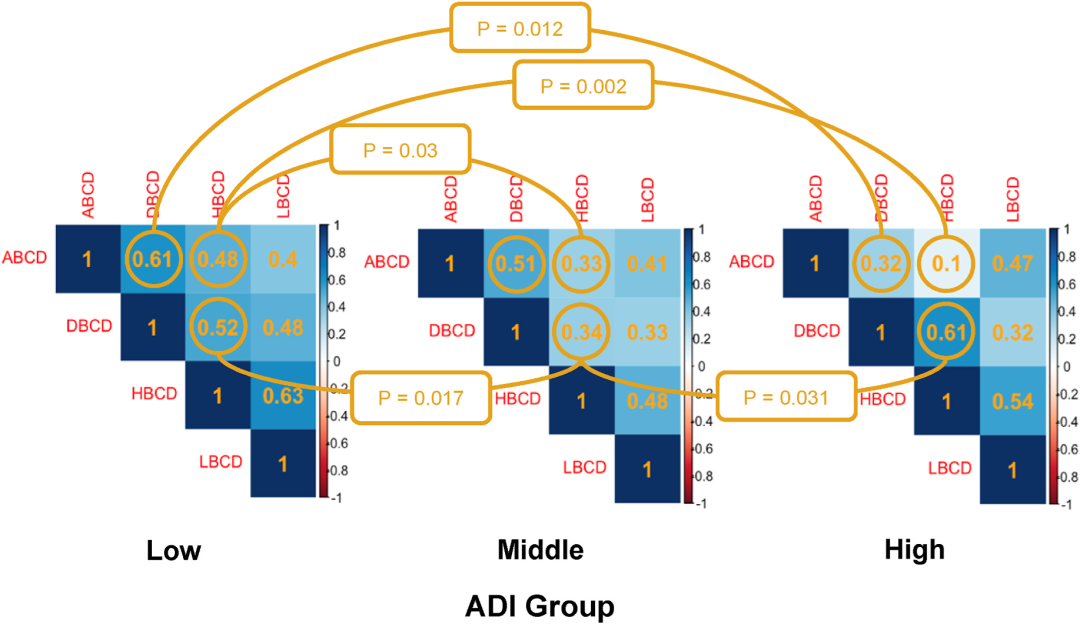
图1. 根据ADI分层的配对心血管代谢驱动因素的多效性交叉相关性
2、血糖异常相关疾病(DBCD)阶段与tDNA算法
美国临床内分泌医师协会(AACE)将DBCD分为4个阶段:分子层面(胰岛素抵抗阶段)、生化心血管代谢风险(糖尿病前期阶段)、生化疾病(T2DM阶段)以及血管并发症(T2DM并发症),鼓励尽早进行干预,重点是结构化的生活方式改变[6]。“跨文化糖尿病营养算法(tDNA)”通过重组国际指导方针以适应不同文化的生活方式、饮食和遗传因素,为糖尿病前期和T2DM患者提供营养管理指导,已在加拿大、巴西、印度等多地区开展应用;AACE还提出一系列物理(食品供应、健身资源)与非物理(种族、信仰)因素检查表,以优化干预策略在不同人群中的适用性与实效性[6]。
3、二甲双胍在全球糖尿病管理中的核心角色
一项系统综述[7]纳入了33项高质量研究并将其分为3个领域:二甲双胍的创新应用,包括其在癌症、心血管疾病、神经退行性疾病和多囊卵巢综合征(PCOS)等领域中的作用;激活AMPK、抑制线粒体呼吸链复合物Ⅰ和肠道微生物群调节等关键作用机制;通过药物递送系统的创新,提高二甲双胍的生物利用度、靶向递送和患者依从性,包括纳米颗粒、pH响应性水凝胶和微针等先进策略(图2)。
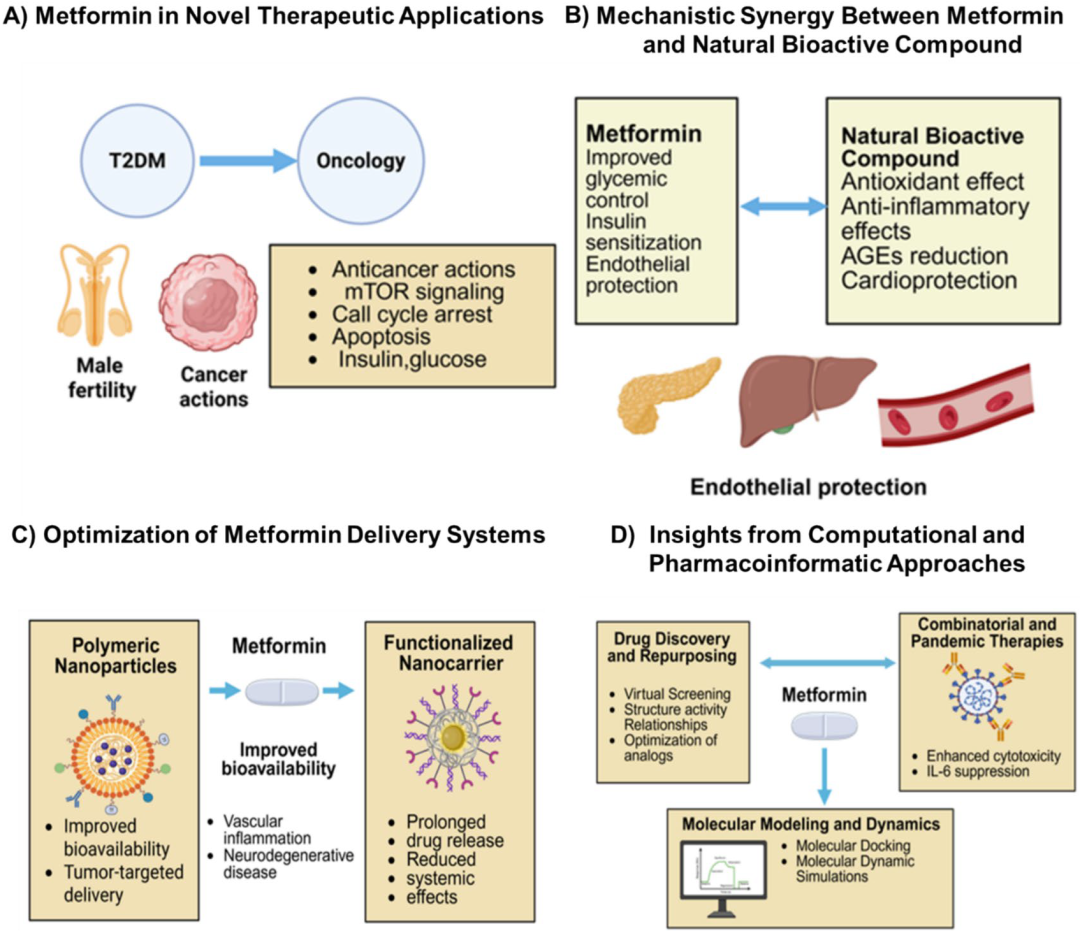
图2. 二甲双胍的创新应用
在指南推荐方面,国际糖尿病联盟(IDF)、美国糖尿病协会(ADA)、加拿大、韩国、印度及拉丁美洲等国际指南/专家共识建议,若无禁忌证,二甲双胍应为T2DM降糖治疗的一线选择;对于合并心血管疾病或心力衰竭等的患者,推荐其与有获益证据的钠-葡萄糖共转运蛋白2抑制剂(SGLT2i)/胰高糖素样肽-1受体激动剂(GLP-1RA)联合使用。
T2DM是tCMBCD关键驱动因素之一,跨文化差异会加剧其疾病异质性和管理难度。在当前治疗策略中,二甲双胍凭借强效降糖、低血糖风险低、低成本以及潜在心血管获益,已成为全球多族裔文化人群中预防和管理高血糖/并发症的有力早期干预措施。在患者心血管风险显著升高或合并心血管疾病时,仍建议将其作为基础用药继续保留。
二、延缓衰老潜力:二甲双胍延缓认知障碍的相关研究异彩纷呈
高胰岛素血症与阿尔茨海默病及相关痴呆(AD/ADRD)之间存在关联[8]。二甲双胍可通过AMPK依赖/非依赖途径,调控糖代谢、减少氧化应激、抑制炎症等过程,从而在糖尿病、衰老与认知下降之间建立联系[9]。基于此,有假设提出二甲双胍等糖尿病药物或可用于防治认知障碍。一项涵盖16项队列研究的Meta分析显示,使用二甲双胍的糖尿病患者全因痴呆风险较非使用者降低23%(RR 0.77,95%CI:0.67~0.88,图3)[10]。
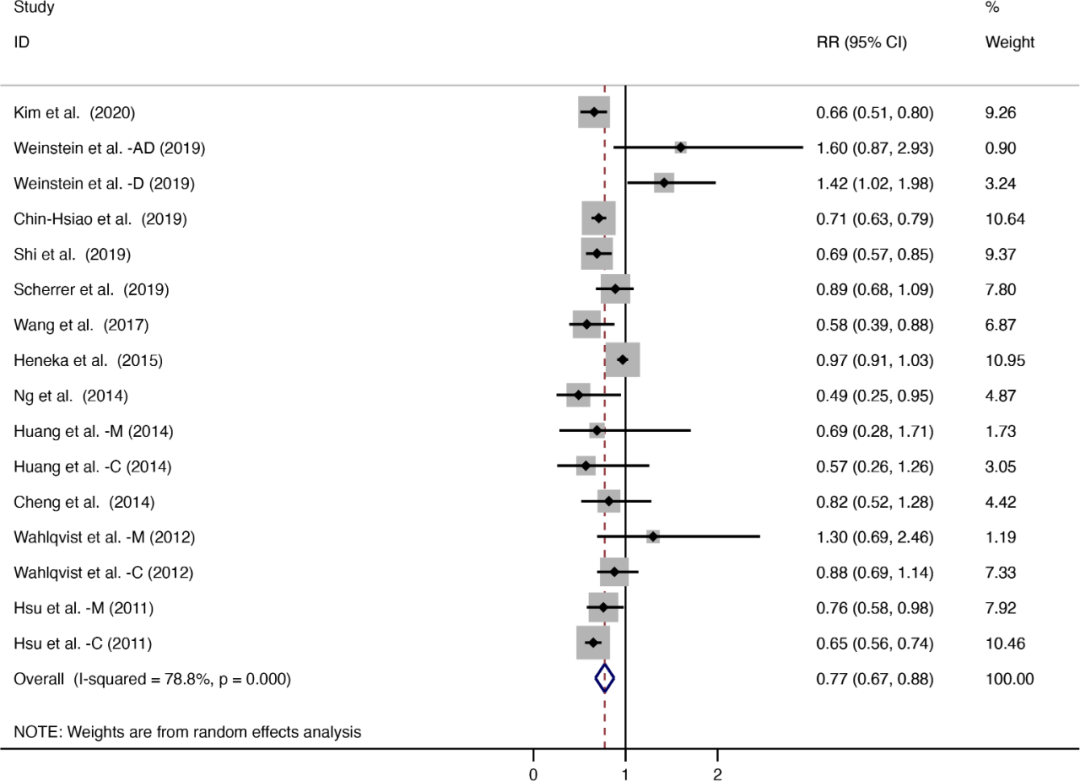
图3. Meta分析显示,使用二甲双胍的糖尿病患者全因痴呆风险较非使用者降低23%
在AD及轻度认知障碍(MCI)的一项探索性研究中,二甲双胍组在Trails B测试(也称为连线测验的B部分,用于评估认知功能)中表现出显著改善,上眶额叶及中眶额叶脑血流量增加,但脑脊液(CSF)中AD生物标志物无变化[11]。另一项针对MCI患者的探索性随机对照临床研究显示,二甲双胍组在选择性提醒测试(SRT)中总回忆度表现优于安慰剂对照组(P=0.02),但AD评估量表认知分量表(ADAS-Cog)评分无统计学差异(P=0.4)[12]。
目前,由Jose Luchsinger教授牵头的“二甲双胍预防AD痴呆(MAP)”试验(NCT04098666)正在进行中。该研究计划纳入326例无糖尿病的遗忘型MCI患者,予以二甲双胍缓释片2000 mg/天,干预18个月,主要终点为自由与线索选择性提醒测试(FCSRT)评分变化,预计2026年4月完成,其结果将为二甲双胍是否具有认知保护作用提供关键证据[13]。
二甲双胍现有研究亦显示出其延缓衰老的潜力,如对老年人肌肉中衰老相关途径产生有益影响,在炎症疾病中调节免疫的功能。MAP试验的辅助研究也设置了免疫功能生物标志物(如白细胞介素-6)和肌肉健康生物标志物(肌肉生长抑制素-卵泡抑制素)的检测。
二甲双胍或可作为延缓认知功能下降的潜在策略,也可能对衰老有益,有待大规模、长期的临床研究进一步验证。MAP试验将在未来12个月内为二甲双胍对认知、肌肉和免疫衰老的益处提供重要答案。
三、聚焦肥胖管理:GLP-1RA停药后二甲双胍减轻体重反弹的潜力
肥胖显著增加糖尿病、冠心病、代谢功能障碍相关脂肪性肝病等多种并发症的风险[14,15],已成全球公共卫生危机。
1、GLP-1RA降低体重同时面临停药与可及性问题
GLP-1RA是新型抗肥胖药物之一[16],但其在真实世界中的应用仍存在挑战。波兰一项队列研究(n=34,024)显示,司美格鲁肽使用者中仅64.6%坚持开具超过12次处方,其他GLP-1RA长期用药率更低[17]。美国一项回顾性队列研究发现,大多数超重/肥胖患者在1年内停止了GLP-1RA治疗[18]。
2、二甲双胍的体重管理证据
DPP研究10年随访结果显示,强化生活方式干预组的糖尿病前期患者体重减轻约2.0 kg,在1年时体重开始反弹,而二甲双胍组初期体重降低约2.5 kg,10年内对体重的影响较为稳定(图4)[19];中国CDPP研究显示,在2年的随访期间,二甲双胍+生活方式干预组体重从基线水平显著下降,平均下降2.11 kg,而单纯生活方式干预组体重平均下降1.16 kg[20]。BIGPRO试验纳入324例腹型肥胖非糖尿病人群,结果显示二甲双胍1700 mg/天干预12个月平均降低体重2.0 kg,而安慰剂组降幅为0.8 kg[21];另一项研究显示,154例BMI≥27 kg/m2患者在接受二甲双胍(最高2500 mg/天)6个月后平均降低体重5.8 kg,未经治疗的对照组则增加0.8 kg[22]。一项Meta分析表明,二甲双胍可显著改善抗精神病药相关体重增加及代谢指标[23]。
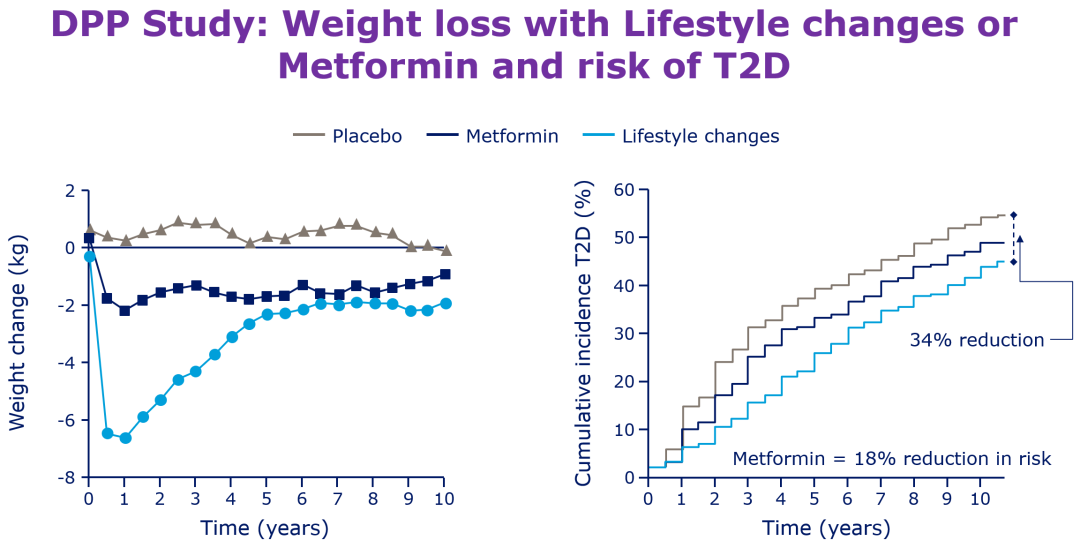
图4. DPP研究:二甲双胍组在体重降低后长期维持体重
3、二甲双胍减轻GLP-1RA停药后体重反弹的探索
近年来,关于GLP-1RA停药后如何维持体重受到持续关注。STEP 1研究表明,司美格鲁肽可使体重减轻17.3%,一旦停药,1年内体重恢复了之前减重幅度的2/3[24]。一项在PCOS肥胖女性中开展的研究显示,持续使用二甲双胍的情况下,司美格鲁肽停药2年内体重仅恢复了之前减重幅度的1/3[25]。一项真实世界研究对GLP-1RA治疗12个月的肥胖患者进行随访,发现后续6个月过渡到二甲双胍等低成本的传统抗肥胖药物治疗,可以抵消停用GLP-1RA预期的体重反弹[26]。
综上所述,二甲双胍在不同超重/肥胖人群中展现出降低体重的潜力,在GLP-1RA停药后使用二甲双胍还显示出减轻体重反弹的前景,值得开展临床研究进一步验证。
四、总结
本次研讨会从三个维度深入解析了二甲双胍的应用前景。在跨文化糖尿病管理方面,其展现出对全球糖尿病异质性的良好适配性,成为早期干预的核心药物。在认知障碍疾病领域,二甲双胍与痴呆风险降低有关,可能对延缓衰老功能有益,正在进行的MAP试验将为二甲双胍在认知、衰老的作用提供关键证据;在体重管理方面,有限的证据提示二甲双胍可能减轻体重反弹,有助于长期管理体重。这场国际专题研讨会拓宽了二甲双胍的临床应用视野,期待今后更多研究不断涌现,完善和巩固二甲双胍的证据链。
注:二甲双胍在中国尚未获批糖尿病前期、阿尔茨海默病、认知障碍、多囊卵巢综合征、降低体重或延缓衰老等适应证。本文仅供医疗卫生专业人士学术交流。
余学锋 教授
华中科技大学同济医学院附属同济医院内分泌科内科学教授,主任医师,博士生导师
中华医学会内分泌学分会常务委员
中国医师协会内分泌代谢科医师分会常务委员
中华预防医学会健康生活方式与社区卫生专业委员会副主任委员
湖北省内分泌学会主任委员
《内科急危重症杂志》副主编、《药品评价》常务编委;《临床内科杂志》《中华糖尿病杂志》《中国糖尿病杂志》《中华老年多器官疾病杂志》《华科大学报》英文版、《中国医学论坛报社》内分泌专家委员会及《糖尿病天地》编委
参考文献
(上下滑动可查看)
1. Jeffrey Mechanick. Configuring Metformin in Transculturalized Diabetes Care Algorithms. Presented at EASD 2025.
2. Jose Luchsinger. Dementia, Aging, and the Effects of Metformin. Presented at EASD 2025.
3. Mohamed Hassanein. Weight maintenance after GLP1RA and the potential of metformin. Presented at EASD 2025.
4. IDF Diabetes Atlas 11th Edition, 2025.
5. Hernandez Sevillano J, et al. Int J Cardiol Cardiovasc Risk Prev. 2024; 23: 200322.
6. Mechanick JI, et al. Endocr Pract. 2019; 25(7): 729-765.
7. Sulong NA, et al. Drug Deliv Transl Res. 2025 Jun 24. doi: 10.1007/s13346-025-01903-y.
8. Luchsinger JA, et al. Neurology. 2004; 63(7): 1187-1192.
9. Lv Z, Guo Y. Frontiers Endo (Lausanne). 2020; 11: 191.
10. Zhang Y, et al. Diabet Med. 2020; 39(6): e14821.
11. Koenig AM, et al. Alzheimer Dis Assoc Disord. 2017; 31(2): 107-113.
12. Luchsinger JA, et al. J Alzheimers Dis. 2016; 51(2): 501-514.
13. J Alzheimer’s Disease 2020; NCT04098666
14. Tsai AG, Bessesen DH. Ann Intern Med. 2019; 170(5): ITC33-ITC48.
15. Sarma S, et al. Diabetes Obes Metab. 2021; 23(1): 3-16.
16. Rodriguez PJ, et al. JAMA Intern Med. 2024;184(9): 1056-1064.
17. Siudak Z, et al. Diabetes Obes Metab. 2025; 27(10): 6011 6017.
18 Rodriguez PJ, et al. JAMA Netw Open. 2025; 8(1): e2457349.
19. Knowler WC, et al. Lancet. 2009; 374(9702): 1677-1686.
20. Zhang L, et al. Lancet Diabetes Endocrinol. 2023; 11(8): 567-577.
21. Fontbonne A, et al. Diabetes Care. 1996; 19(9): 920-926.
22. Seifarth C, et al. Exp Clin Endocrinol Diabetes. 2013; 121(1): 27-31.
23. Yu O, et al. Ther Adv Psychopharmacol. 2024; 14: 20451253241255476.
24. Wilding JPH, et al. Diabetes Obes Metab. 2022; 24(8): 1553-1564.
25. Jensterle M, et al. Front Endocrinol (Lausanne). 2024; 15: 1366940
26. Paddu NU, et al. Obesity (Silver Spring). 2024; 32(12): 2255-2263.
CN-MET-00132 有效期到2027年9月15日
2 comments
二甲双胍临床应用逾六十载,是2型糖尿病(T2DM)治疗的基石药物,改善了全球糖尿病患者的健康状况。正在奥地利维也纳举办的第61届欧洲糖尿病研究协会年会(EASD 2025)上,一场“二甲双胍与糖尿病的未来”的专题研讨会备受关注。来自美国西奈山伊坎医学院Jeffrey Mechanick教授,与哥伦比亚大学欧文医学中心Jose Luchsinger教授及阿联酋穆罕默德·本·拉希德大学Mohamed Hassanein教授分别从全球糖尿病早期干预、认知保护及体重维持三大维度[1-3]分享最新见解,为糖尿病治疗的未来揭示了兼具全球视野与循证指导的二甲双胍应用新潜力。本刊特邀华中科技大学同济医学院附属同济医院余学锋教授进行详细介绍。

一、跨文化适配:二甲双胍仍是全球糖尿病管理的核心选择
全球糖尿病正面临疾病负担高与异质性高的双重挑战。2024年全球糖尿病患者人数已达5.887亿,预计到2050年将增至8.525亿[4]。糖尿病常与肥胖、高血压及血脂异常形成共病网络,而不同地区在饮食习惯、经济发展水平和医疗资源可及性方面差异显著,采用“统一化”管理难以普遍适用。因此,明确二甲双胍在跨文化背景下的核心定位显得尤为重要。
1、tCMBCD模型提示共病管理需考虑社会环境对心血管代谢疾病的影响
为整合多疾病风险,研究者提出了一个三维、跨文化、心血管代谢慢性疾病(tCMBCD)模型,涵盖肥胖相关疾病(ABCD)、血糖异常相关疾病(DBCD)、高血压相关疾病(HBCD)、血脂异常相关疾病(LBCD)[5]。研究表明,社会因素显著影响心血管代谢疾病关联:在区域剥夺指数(ADI)较高地区(ADI分数越高,表示社会经济条件越差),ABCD与DBCD的相关性(r=0.32)远低于ADI较低地区(r=0.61,P=0.012)(图1)。这一结果提示,跨文化管理需优先考量社会环境差异[5]。

图1. 根据ADI分层的配对心血管代谢驱动因素的多效性交叉相关性
2、血糖异常相关疾病(DBCD)阶段与tDNA算法
美国临床内分泌医师协会(AACE)将DBCD分为4个阶段:分子层面(胰岛素抵抗阶段)、生化心血管代谢风险(糖尿病前期阶段)、生化疾病(T2DM阶段)以及血管并发症(T2DM并发症),鼓励尽早进行干预,重点是结构化的生活方式改变[6]。“跨文化糖尿病营养算法(tDNA)”通过重组国际指导方针以适应不同文化的生活方式、饮食和遗传因素,为糖尿病前期和T2DM患者提供营养管理指导,已在加拿大、巴西、印度等多地区开展应用;AACE还提出一系列物理(食品供应、健身资源)与非物理(种族、信仰)因素检查表,以优化干预策略在不同人群中的适用性与实效性[6]。
3、二甲双胍在全球糖尿病管理中的核心角色
一项系统综述[7]纳入了33项高质量研究并将其分为3个领域:二甲双胍的创新应用,包括其在癌症、心血管疾病、神经退行性疾病和多囊卵巢综合征(PCOS)等领域中的作用;激活AMPK、抑制线粒体呼吸链复合物Ⅰ和肠道微生物群调节等关键作用机制;通过药物递送系统的创新,提高二甲双胍的生物利用度、靶向递送和患者依从性,包括纳米颗粒、pH响应性水凝胶和微针等先进策略(图2)。

图2. 二甲双胍的创新应用
在指南推荐方面,国际糖尿病联盟(IDF)、美国糖尿病协会(ADA)、加拿大、韩国、印度及拉丁美洲等国际指南/专家共识建议,若无禁忌证,二甲双胍应为T2DM降糖治疗的一线选择;对于合并心血管疾病或心力衰竭等的患者,推荐其与有获益证据的钠-葡萄糖共转运蛋白2抑制剂(SGLT2i)/胰高糖素样肽-1受体激动剂(GLP-1RA)联合使用。
T2DM是tCMBCD关键驱动因素之一,跨文化差异会加剧其疾病异质性和管理难度。在当前治疗策略中,二甲双胍凭借强效降糖、低血糖风险低、低成本以及潜在心血管获益,已成为全球多族裔文化人群中预防和管理高血糖/并发症的有力早期干预措施。在患者心血管风险显著升高或合并心血管疾病时,仍建议将其作为基础用药继续保留。
二、延缓衰老潜力:二甲双胍延缓认知障碍的相关研究异彩纷呈
高胰岛素血症与阿尔茨海默病及相关痴呆(AD/ADRD)之间存在关联[8]。二甲双胍可通过AMPK依赖/非依赖途径,调控糖代谢、减少氧化应激、抑制炎症等过程,从而在糖尿病、衰老与认知下降之间建立联系[9]。基于此,有假设提出二甲双胍等糖尿病药物或可用于防治认知障碍。一项涵盖16项队列研究的Meta分析显示,使用二甲双胍的糖尿病患者全因痴呆风险较非使用者降低23%(RR 0.77,95%CI:0.67~0.88,图3)[10]。

图3. Meta分析显示,使用二甲双胍的糖尿病患者全因痴呆风险较非使用者降低23%
在AD及轻度认知障碍(MCI)的一项探索性研究中,二甲双胍组在Trails B测试(也称为连线测验的B部分,用于评估认知功能)中表现出显著改善,上眶额叶及中眶额叶脑血流量增加,但脑脊液(CSF)中AD生物标志物无变化[11]。另一项针对MCI患者的探索性随机对照临床研究显示,二甲双胍组在选择性提醒测试(SRT)中总回忆度表现优于安慰剂对照组(P=0.02),但AD评估量表认知分量表(ADAS-Cog)评分无统计学差异(P=0.4)[12]。
目前,由Jose Luchsinger教授牵头的“二甲双胍预防AD痴呆(MAP)”试验(NCT04098666)正在进行中。该研究计划纳入326例无糖尿病的遗忘型MCI患者,予以二甲双胍缓释片2000 mg/天,干预18个月,主要终点为自由与线索选择性提醒测试(FCSRT)评分变化,预计2026年4月完成,其结果将为二甲双胍是否具有认知保护作用提供关键证据[13]。
二甲双胍现有研究亦显示出其延缓衰老的潜力,如对老年人肌肉中衰老相关途径产生有益影响,在炎症疾病中调节免疫的功能。MAP试验的辅助研究也设置了免疫功能生物标志物(如白细胞介素-6)和肌肉健康生物标志物(肌肉生长抑制素-卵泡抑制素)的检测。
二甲双胍或可作为延缓认知功能下降的潜在策略,也可能对衰老有益,有待大规模、长期的临床研究进一步验证。MAP试验将在未来12个月内为二甲双胍对认知、肌肉和免疫衰老的益处提供重要答案。
三、聚焦肥胖管理:GLP-1RA停药后二甲双胍减轻体重反弹的潜力
肥胖显著增加糖尿病、冠心病、代谢功能障碍相关脂肪性肝病等多种并发症的风险[14,15],已成全球公共卫生危机。
1、GLP-1RA降低体重同时面临停药与可及性问题
GLP-1RA是新型抗肥胖药物之一[16],但其在真实世界中的应用仍存在挑战。波兰一项队列研究(n=34,024)显示,司美格鲁肽使用者中仅64.6%坚持开具超过12次处方,其他GLP-1RA长期用药率更低[17]。美国一项回顾性队列研究发现,大多数超重/肥胖患者在1年内停止了GLP-1RA治疗[18]。
2、二甲双胍的体重管理证据
DPP研究10年随访结果显示,强化生活方式干预组的糖尿病前期患者体重减轻约2.0 kg,在1年时体重开始反弹,而二甲双胍组初期体重降低约2.5 kg,10年内对体重的影响较为稳定(图4)[19];中国CDPP研究显示,在2年的随访期间,二甲双胍+生活方式干预组体重从基线水平显著下降,平均下降2.11 kg,而单纯生活方式干预组体重平均下降1.16 kg[20]。BIGPRO试验纳入324例腹型肥胖非糖尿病人群,结果显示二甲双胍1700 mg/天干预12个月平均降低体重2.0 kg,而安慰剂组降幅为0.8 kg[21];另一项研究显示,154例BMI≥27 kg/m2患者在接受二甲双胍(最高2500 mg/天)6个月后平均降低体重5.8 kg,未经治疗的对照组则增加0.8 kg[22]。一项Meta分析表明,二甲双胍可显著改善抗精神病药相关体重增加及代谢指标[23]。

图4. DPP研究:二甲双胍组在体重降低后长期维持体重
3、二甲双胍减轻GLP-1RA停药后体重反弹的探索
近年来,关于GLP-1RA停药后如何维持体重受到持续关注。STEP 1研究表明,司美格鲁肽可使体重减轻17.3%,一旦停药,1年内体重恢复了之前减重幅度的2/3[24]。一项在PCOS肥胖女性中开展的研究显示,持续使用二甲双胍的情况下,司美格鲁肽停药2年内体重仅恢复了之前减重幅度的1/3[25]。一项真实世界研究对GLP-1RA治疗12个月的肥胖患者进行随访,发现后续6个月过渡到二甲双胍等低成本的传统抗肥胖药物治疗,可以抵消停用GLP-1RA预期的体重反弹[26]。
综上所述,二甲双胍在不同超重/肥胖人群中展现出降低体重的潜力,在GLP-1RA停药后使用二甲双胍还显示出减轻体重反弹的前景,值得开展临床研究进一步验证。
四、总结
本次研讨会从三个维度深入解析了二甲双胍的应用前景。在跨文化糖尿病管理方面,其展现出对全球糖尿病异质性的良好适配性,成为早期干预的核心药物。在认知障碍疾病领域,二甲双胍与痴呆风险降低有关,可能对延缓衰老功能有益,正在进行的MAP试验将为二甲双胍在认知、衰老的作用提供关键证据;在体重管理方面,有限的证据提示二甲双胍可能减轻体重反弹,有助于长期管理体重。这场国际专题研讨会拓宽了二甲双胍的临床应用视野,期待今后更多研究不断涌现,完善和巩固二甲双胍的证据链。
注:二甲双胍在中国尚未获批糖尿病前期、阿尔茨海默病、认知障碍、多囊卵巢综合征、降低体重或延缓衰老等适应证。本文仅供医疗卫生专业人士学术交流。
余学锋 教授
华中科技大学同济医学院附属同济医院内分泌科内科学教授,主任医师,博士生导师
中华医学会内分泌学分会常务委员
中国医师协会内分泌代谢科医师分会常务委员
中华预防医学会健康生活方式与社区卫生专业委员会副主任委员
湖北省内分泌学会主任委员
《内科急危重症杂志》副主编、《药品评价》常务编委;《临床内科杂志》《中华糖尿病杂志》《中国糖尿病杂志》《中华老年多器官疾病杂志》《华科大学报》英文版、《中国医学论坛报社》内分泌专家委员会及《糖尿病天地》编委
参考文献
(上下滑动可查看)
1. Jeffrey Mechanick. Configuring Metformin in Transculturalized Diabetes Care Algorithms. Presented at EASD 2025.
2. Jose Luchsinger. Dementia, Aging, and the Effects of Metformin. Presented at EASD 2025.
3. Mohamed Hassanein. Weight maintenance after GLP1RA and the potential of metformin. Presented at EASD 2025.
4. IDF Diabetes Atlas 11th Edition, 2025.
5. Hernandez Sevillano J, et al. Int J Cardiol Cardiovasc Risk Prev. 2024; 23: 200322.
6. Mechanick JI, et al. Endocr Pract. 2019; 25(7): 729-765.
7. Sulong NA, et al. Drug Deliv Transl Res. 2025 Jun 24. doi: 10.1007/s13346-025-01903-y.
8. Luchsinger JA, et al. Neurology. 2004; 63(7): 1187-1192.
9. Lv Z, Guo Y. Frontiers Endo (Lausanne). 2020; 11: 191.
10. Zhang Y, et al. Diabet Med. 2020; 39(6): e14821.
11. Koenig AM, et al. Alzheimer Dis Assoc Disord. 2017; 31(2): 107-113.
12. Luchsinger JA, et al. J Alzheimers Dis. 2016; 51(2): 501-514.
13. J Alzheimer’s Disease 2020; NCT04098666
14. Tsai AG, Bessesen DH. Ann Intern Med. 2019; 170(5): ITC33-ITC48.
15. Sarma S, et al. Diabetes Obes Metab. 2021; 23(1): 3-16.
16. Rodriguez PJ, et al. JAMA Intern Med. 2024;184(9): 1056-1064.
17. Siudak Z, et al. Diabetes Obes Metab. 2025; 27(10): 6011 6017.
18 Rodriguez PJ, et al. JAMA Netw Open. 2025; 8(1): e2457349.
19. Knowler WC, et al. Lancet. 2009; 374(9702): 1677-1686.
20. Zhang L, et al. Lancet Diabetes Endocrinol. 2023; 11(8): 567-577.
21. Fontbonne A, et al. Diabetes Care. 1996; 19(9): 920-926.
22. Seifarth C, et al. Exp Clin Endocrinol Diabetes. 2013; 121(1): 27-31.
23. Yu O, et al. Ther Adv Psychopharmacol. 2024; 14: 20451253241255476.
24. Wilding JPH, et al. Diabetes Obes Metab. 2022; 24(8): 1553-1564.
25. Jensterle M, et al. Front Endocrinol (Lausanne). 2024; 15: 1366940
26. Paddu NU, et al. Obesity (Silver Spring). 2024; 32(12): 2255-2263.
CN-MET-00132 有效期到2027年9月15日
2 comments











 京公网安备 11010502033361号
京公网安备 11010502033361号
发布留言