编者按
随着全球肥胖症和2型糖尿病(T2DM)患者数量的不断攀升,研发新型、高效的治疗药物已成为医学领域的当务之急。GLP-1/GIP双受体激动剂通过同时激活胰高糖素样肽-1(GLP-1)和葡萄糖依赖性促胰岛素释放多肽(GIP)受体来发挥降糖、减重作用,在提高疗效的同时减少剂量依赖性不良反应的发生。目前,全球进入临床阶段的GLP-1/GIP双靶点激动剂达10余款,除1款已上市产品外,HRS9531的研发进度位于全球第2。
正在火热进行中的第85届美国糖尿病协会年会(ADA2025)备受瞩目,恒瑞医药自主研发的GLP-1/GIP双受体激动剂HRS9531相关研究——2项在超重或肥胖受试者中评估HRS9531注射液的有效性和安全性、1项在健康人群中评估口服HRS9531片剂的药效/药代学特征及安全性、耐受性,为我们带来了国内处于领先地位的GLP-1/GIP双受体激动剂研发进展全貌。本文全面梳理了上述HRS9531的3项最新临床研究,以飨读者。
ADA 2025
目的
此项Ⅱ期临床研究旨在评估HRS9531在中国不合并糖尿病的超重或肥胖成人受试者中的有效性与安全性。
方法
一项随机、双盲、安慰剂对照的Ⅱ期研究,纳入体重指数(BMI)为28.0~40.0 kg/m2的中国成年肥胖受试者,或BMI为24.0~28.0 kg/m2且至少有一种与体重相关的合并症的超重患者。受试者随机接受每周一次皮下注射HRS9531 8.0 mg或安慰剂治疗36周。主要终点是治疗36周后,体重相对基线变化的百分比。
结果
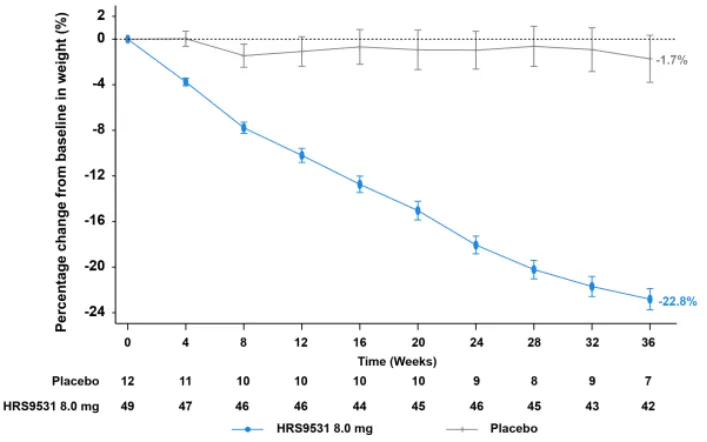
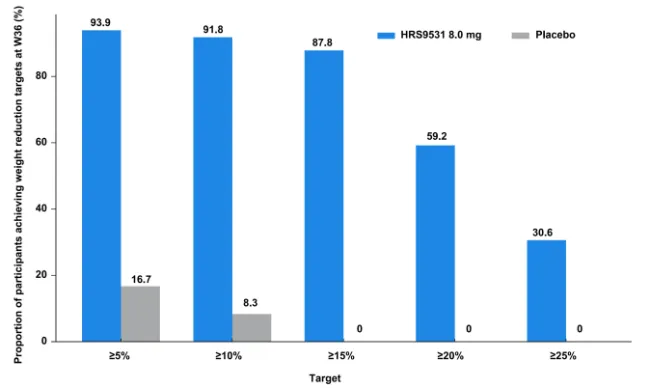
研究共纳入61例超重或肥胖受试者,随机分配至HRS9531 8.0 mg组(n=49)或安慰剂组(n=12)。两组基线特征总体相当。基线平均体重为84.6 kg,基线平均BMI为31.3 kg/m2。在第36周,HRS9531 8.0 mg组体重自基线的变化为-22.8%,安慰剂组为-1.7%,组间变化差异为-21.1%(P<0.0001)(图1)。HRS9531 8.0 mg组中分别有93.9%、91.8%、87.8%、59.2%和30.6%的受试者实现了≥5%、≥10%、≥15%、≥20%和≥25%的体重减轻,而安慰剂组分别为16.7%、8.3%、0%、0%和0%(图2)。
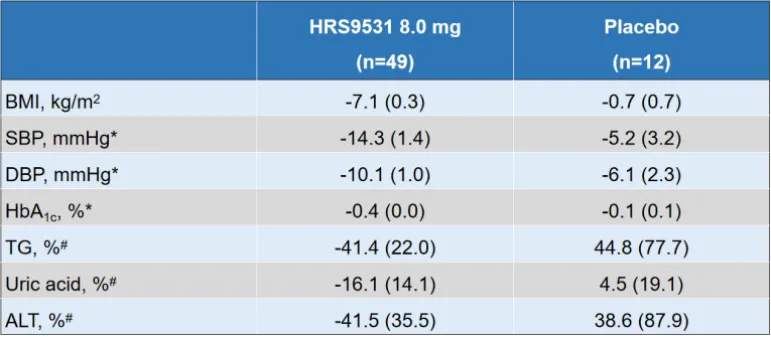
此外,在第36周,HRS9531 8.0 mg组的腰围变化为-17.9 cm,而安慰剂组为-2.5 cm。同时,BMI、血压、甘油三酯、尿酸、糖化血红蛋白(HbA1c)和谷丙转氨酶(ALT)水平在治疗组改善更优(表1)。
表1. 36周时其他指标自基线的变化
结论
在不合并糖尿病的超重或肥胖成人受试者中,每周一次皮下注射HRS9531治疗36周显著减轻体重,有效降低血压、血脂,且整体安全性良好。
评估GLP-1/GIP双受体激动剂HRS9531注射液在中国肥胖受试者中治疗长达52周的有效性和安全性[2]
目的
Ⅱ期研究核心治疗期结果已显示HRS9531注射液治疗24周后具有显著的减重效果,此次为期28周的延伸研究旨在评估其在非糖尿病肥胖成人中的长期疗效和安全性。
方法
该研究纳入BMI 为28~40 kg/m2的中国成人肥胖受试者,并随机(1:1:1:1:1)分配至HRS9531组(每周一次皮下注射1.0、3.0、4.5或6.0 mg)或安慰剂组,持续治疗24周(核心治疗期),随后进入28周的延伸期。在28周的延伸期内,前8周维持先前核心治疗期的用药剂量和治疗方案不变,之后受试者均接受HRS9531治疗20周:安慰剂组和HRS9531 1.0 mg组转换为HRS9531 3.0 mg,每周一次皮下注射(QW),而其他组则组内重新随机分配为QW或每两周一次(Q2W)给药。
结果
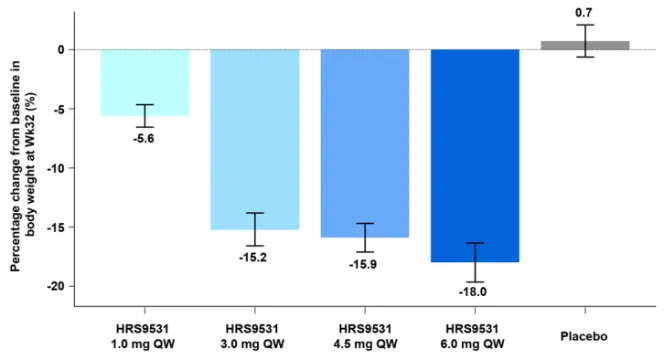
在249例入组的受试者中,240例(96.8%)完成了24周的核心治疗期;168例受进入延伸期,其中166例(98.8%)完成了32周的安慰剂对照治疗期。在第32周时,与安慰剂组体重增加0.74%相比,HRS9531组平均体重减少最高达18.0%(图3),体重减少≥5%、≥10%的比例分别高达100.0%和88.5%,而安慰剂组分别为12.5%和9.4%。此外,HRS9531 6.0 mg组腰围的变化为-13.8 cm,而安慰剂组为-2.0 cm。
从第32~52周,HRS9531 Q2W组的体重较32周平均变化为-0.76%~0.01%,而HRS9531 QW组为-3.45%~-0.02%。提示,每两周一次的给药方案可有效维持减重效果,未出现体重反弹。
同时,在第32周时,HRS9531在改善BMI、血压、血糖、甘油三酯、尿酸和ALT水平方面数值上优于安慰剂。
在为期32周的安慰剂对照治疗期间,HRS9531各组报告的TEAEs发生率为75.5%~91.8%,而安慰剂组为85.7%。大多数TEAEs为轻度至中度,其中胃肠道事件最为常见。在整个52周的治疗期间,未发现HRS9531新的安全性问题。
结论
在非糖尿病的肥胖成人中,与安慰剂相比,HRS9531治疗在32周内明显降低体重。在32周治疗后,改为每两周一次的给药方案有效地维持了已实现的体重减轻,且耐受性良好。
HRS9531片在健康受试者中单次给药和多次给药的安全性、耐受性、药代动力学及药效学的I期临床研究[3]
背景和目的
HRS9531片是上述HRS9531注射液的口服剂型,也是国内首个在国际舞台公布数据的口服GLP-1/GIP多肽制剂。该口服剂型的研发有助于提高患者的便利性、接受度和依从性。该Ⅰ期研究旨在评估HRS9531片在健康受试者中单次递增剂量(SAD)和多次递增剂量(MAD)的安全性和耐受性。
方法
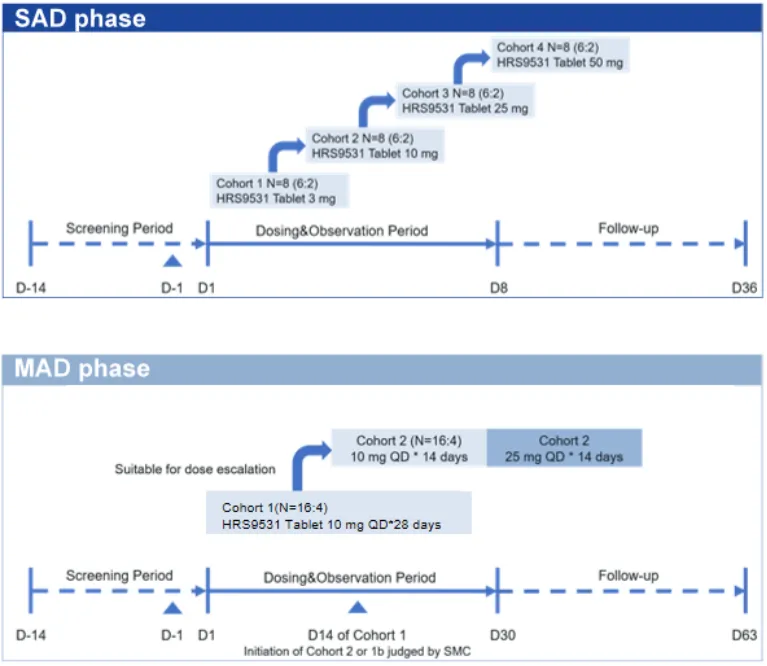
SAD阶段,健康男性受试者随机接受单次剂量的HRS9531片或安慰剂。MAD阶段,健康男性受试者随机接受HRS9531片或安慰剂,组1受试者接受10 mg QD,连续给药28天。组2受试者接受10 mg QD连续给药14天后,滴定至25 mg QD连续给药14天(图4)。
结果
SAD和MAD阶段分别纳入32例和40例健康受试者。所有HRS9531片组的TEAEs均为轻度至中度。SAD中HRS9531片剂所有TEAEs发生率为62.5%,安慰剂组为75%,均为轻度。HRS9531组最常见的胃肠道TEAEs为恶心、呕吐和腹胀,发生率均为16.7%。
MAD阶段, HRS9531片TEAEs发生率为84.4%,安慰剂组为62.5%,绝大多数为轻度。HRS9531片最常见的TEAEs为高尿酸血症(34.4%)、高甘油三酯血症(18.8%),胃肠道TEAE最常见的是恶心(15.6%)。未报告严重不良事件或低血糖事件。
整体而言,HRS9531片的暴露量随剂量增加,吸收后的排泄与注射剂一致,消除半衰期约为168小时。连续给药10~14天后,吸收变异趋于稳定(CV%约50%)。给予10 mg片剂28天后,平均稳态血浆浓度(Cavg,ss)的几何平均值为313 ng/mL。
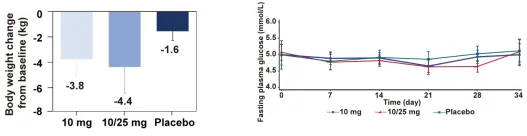
MAD结果显示,第29天时,10 mg组和10/25 mg组的平均体重下降分别为3.8 kg和4.4 kg,而安慰剂组为1.6 kg(图5左)。10 mg组和10/25 mg组体重相对基线变化的百分比分别为4.7%和5.4%,而安慰剂组为1.9%。空腹血糖水平也呈剂量依赖性下降(图5右)。
结论
HRS9531片剂显示出良好的安全性和耐受性,与该类药物相关特征一致。MAD结果显示,相较于安慰剂组,使用HRS9531片29天后,10 mg组和10/25 mg组的体重和血糖水平均有下降。该结果支持HRS9531片剂用于代谢性疾病的进一步临床开发。
总结和展望
HRS9531是由恒瑞医药自主研发的GLP-1/GIP双受体激动剂,目前处于国内领先研发阶段,此前公布的为期24周、20周的研究显示其在肥胖症和T2DM患者中具有巨大研发价值[4-5]。此次ADA年会上公布的36~52周研究进一步显示在中国超重或肥胖成人受试者中每周一次皮下注射HRS9531具有显著的减重作用,并改善了多项心肾代谢指标,且安全性、耐受性良好,胃肠道不良反应较为常见,多呈轻中度。此外,研究还发现,治疗32周后,每两周一次的给药方案有效地维持了已实现的体重减轻,提示肥胖患者达到一定的体重减轻后,可减少给药次数以维持效果。
口服制剂具有更好的便利性,有利于提高治疗依从性,实现更佳的治疗效果。HRS9531片作为国内首个在国际舞台公布数据的口服GLP-1/GIP多肽制剂,其临床价值也在积极探索中。此次ADA年会上公布的Ⅰ期研究显示,HRS9531片在健康受试者中具有良好的安全性和耐受性,药代动力学特性与注射制剂一致,且MAD结果也显示,HRS9531片具有明确的减重和降糖作用。
综上所述,HRS9531的临床研究结果为其在超重或肥胖症治疗中的应用提供了有力支持,HRS9531片剂的开发有望为患者提供更为便捷的治疗选择,提高治疗依从性。随着更多临床数据的积累,HRS9531或将成为T2DM和肥胖症治疗领域的重要药物之一,为患者带来更多的治疗选择和希望。
参考文献
1. Efficacy and Safety of HRS9531, a Novel Dual GLP-1/GIP Receptor Agonist, in Chinese Overweight or Obese Adults Without Diabetes
2. Efficacy and Safety of a Novel Dual GLP-1/GIP Receptor Agonist (HRS9531), in Obese Adults Without Diabetes: Up to 52-week treatment
3. Safety, Tolerability, Pharmacokinetics, and Pharmacodynamics of HRS9531 Tablet, an Oral Dual GLP-1/GIP Receptor Agonist, in Healthy Participants: A Phase 1 Study
4. Zhao L, et al. 1861-LB Efficacy and Safety of HRS9531, a Novel Dual GLP-1/GIP Receptor Agonist, in Obese Adults: A Phase 2 Trial. Presented at ADA 2024.
随着全球肥胖症和2型糖尿病(T2DM)患者数量的不断攀升,研发新型、高效的治疗药物已成为医学领域的当务之急。GLP-1/GIP双受体激动剂通过同时激活胰高糖素样肽-1(GLP-1)和葡萄糖依赖性促胰岛素释放多肽(GIP)受体来发挥降糖、减重作用,在提高疗效的同时减少剂量依赖性不良反应的发生。目前,全球进入临床阶段的GLP-1/GIP双靶点激动剂达10余款,除1款已上市产品外,HRS9531的研发进度位于全球第2。
正在火热进行中的第85届美国糖尿病协会年会(ADA2025)备受瞩目,恒瑞医药自主研发的GLP-1/GIP双受体激动剂HRS9531相关研究——2项在超重或肥胖受试者中评估HRS9531注射液的有效性和安全性、1项在健康人群中评估口服HRS9531片剂的药效/药代学特征及安全性、耐受性,为我们带来了国内处于领先地位的GLP-1/GIP双受体激动剂研发进展全貌。本文全面梳理了上述HRS9531的3项最新临床研究,以飨读者。
ADA 2025
目的
此项Ⅱ期临床研究旨在评估HRS9531在中国不合并糖尿病的超重或肥胖成人受试者中的有效性与安全性。
方法
一项随机、双盲、安慰剂对照的Ⅱ期研究,纳入体重指数(BMI)为28.0~40.0 kg/m2的中国成年肥胖受试者,或BMI为24.0~28.0 kg/m2且至少有一种与体重相关的合并症的超重患者。受试者随机接受每周一次皮下注射HRS9531 8.0 mg或安慰剂治疗36周。主要终点是治疗36周后,体重相对基线变化的百分比。
结果
研究共纳入61例超重或肥胖受试者,随机分配至HRS9531 8.0 mg组(n=49)或安慰剂组(n=12)。两组基线特征总体相当。基线平均体重为84.6 kg,基线平均BMI为31.3 kg/m2。在第36周,HRS9531 8.0 mg组体重自基线的变化为-22.8%,安慰剂组为-1.7%,组间变化差异为-21.1%(P<0.0001)(图1)。HRS9531 8.0 mg组中分别有93.9%、91.8%、87.8%、59.2%和30.6%的受试者实现了≥5%、≥10%、≥15%、≥20%和≥25%的体重减轻,而安慰剂组分别为16.7%、8.3%、0%、0%和0%(图2)。
此外,在第36周,HRS9531 8.0 mg组的腰围变化为-17.9 cm,而安慰剂组为-2.5 cm。同时,BMI、血压、甘油三酯、尿酸、糖化血红蛋白(HbA1c)和谷丙转氨酶(ALT)水平在治疗组改善更优(表1)。
表1. 36周时其他指标自基线的变化
结论
在不合并糖尿病的超重或肥胖成人受试者中,每周一次皮下注射HRS9531治疗36周显著减轻体重,有效降低血压、血脂,且整体安全性良好。
评估GLP-1/GIP双受体激动剂HRS9531注射液在中国肥胖受试者中治疗长达52周的有效性和安全性[2]
目的
Ⅱ期研究核心治疗期结果已显示HRS9531注射液治疗24周后具有显著的减重效果,此次为期28周的延伸研究旨在评估其在非糖尿病肥胖成人中的长期疗效和安全性。
方法
该研究纳入BMI 为28~40 kg/m2的中国成人肥胖受试者,并随机(1:1:1:1:1)分配至HRS9531组(每周一次皮下注射1.0、3.0、4.5或6.0 mg)或安慰剂组,持续治疗24周(核心治疗期),随后进入28周的延伸期。在28周的延伸期内,前8周维持先前核心治疗期的用药剂量和治疗方案不变,之后受试者均接受HRS9531治疗20周:安慰剂组和HRS9531 1.0 mg组转换为HRS9531 3.0 mg,每周一次皮下注射(QW),而其他组则组内重新随机分配为QW或每两周一次(Q2W)给药。
结果
在249例入组的受试者中,240例(96.8%)完成了24周的核心治疗期;168例受进入延伸期,其中166例(98.8%)完成了32周的安慰剂对照治疗期。在第32周时,与安慰剂组体重增加0.74%相比,HRS9531组平均体重减少最高达18.0%(图3),体重减少≥5%、≥10%的比例分别高达100.0%和88.5%,而安慰剂组分别为12.5%和9.4%。此外,HRS9531 6.0 mg组腰围的变化为-13.8 cm,而安慰剂组为-2.0 cm。
从第32~52周,HRS9531 Q2W组的体重较32周平均变化为-0.76%~0.01%,而HRS9531 QW组为-3.45%~-0.02%。提示,每两周一次的给药方案可有效维持减重效果,未出现体重反弹。
同时,在第32周时,HRS9531在改善BMI、血压、血糖、甘油三酯、尿酸和ALT水平方面数值上优于安慰剂。
在为期32周的安慰剂对照治疗期间,HRS9531各组报告的TEAEs发生率为75.5%~91.8%,而安慰剂组为85.7%。大多数TEAEs为轻度至中度,其中胃肠道事件最为常见。在整个52周的治疗期间,未发现HRS9531新的安全性问题。
结论
在非糖尿病的肥胖成人中,与安慰剂相比,HRS9531治疗在32周内明显降低体重。在32周治疗后,改为每两周一次的给药方案有效地维持了已实现的体重减轻,且耐受性良好。
HRS9531片在健康受试者中单次给药和多次给药的安全性、耐受性、药代动力学及药效学的I期临床研究[3]
背景和目的
HRS9531片是上述HRS9531注射液的口服剂型,也是国内首个在国际舞台公布数据的口服GLP-1/GIP多肽制剂。该口服剂型的研发有助于提高患者的便利性、接受度和依从性。该Ⅰ期研究旨在评估HRS9531片在健康受试者中单次递增剂量(SAD)和多次递增剂量(MAD)的安全性和耐受性。
方法
SAD阶段,健康男性受试者随机接受单次剂量的HRS9531片或安慰剂。MAD阶段,健康男性受试者随机接受HRS9531片或安慰剂,组1受试者接受10 mg QD,连续给药28天。组2受试者接受10 mg QD连续给药14天后,滴定至25 mg QD连续给药14天(图4)。
结果
SAD和MAD阶段分别纳入32例和40例健康受试者。所有HRS9531片组的TEAEs均为轻度至中度。SAD中HRS9531片剂所有TEAEs发生率为62.5%,安慰剂组为75%,均为轻度。HRS9531组最常见的胃肠道TEAEs为恶心、呕吐和腹胀,发生率均为16.7%。
MAD阶段, HRS9531片TEAEs发生率为84.4%,安慰剂组为62.5%,绝大多数为轻度。HRS9531片最常见的TEAEs为高尿酸血症(34.4%)、高甘油三酯血症(18.8%),胃肠道TEAE最常见的是恶心(15.6%)。未报告严重不良事件或低血糖事件。
整体而言,HRS9531片的暴露量随剂量增加,吸收后的排泄与注射剂一致,消除半衰期约为168小时。连续给药10~14天后,吸收变异趋于稳定(CV%约50%)。给予10 mg片剂28天后,平均稳态血浆浓度(Cavg,ss)的几何平均值为313 ng/mL。
MAD结果显示,第29天时,10 mg组和10/25 mg组的平均体重下降分别为3.8 kg和4.4 kg,而安慰剂组为1.6 kg(图5左)。10 mg组和10/25 mg组体重相对基线变化的百分比分别为4.7%和5.4%,而安慰剂组为1.9%。空腹血糖水平也呈剂量依赖性下降(图5右)。
结论
HRS9531片剂显示出良好的安全性和耐受性,与该类药物相关特征一致。MAD结果显示,相较于安慰剂组,使用HRS9531片29天后,10 mg组和10/25 mg组的体重和血糖水平均有下降。该结果支持HRS9531片剂用于代谢性疾病的进一步临床开发。
总结和展望
HRS9531是由恒瑞医药自主研发的GLP-1/GIP双受体激动剂,目前处于国内领先研发阶段,此前公布的为期24周、20周的研究显示其在肥胖症和T2DM患者中具有巨大研发价值[4-5]。此次ADA年会上公布的36~52周研究进一步显示在中国超重或肥胖成人受试者中每周一次皮下注射HRS9531具有显著的减重作用,并改善了多项心肾代谢指标,且安全性、耐受性良好,胃肠道不良反应较为常见,多呈轻中度。此外,研究还发现,治疗32周后,每两周一次的给药方案有效地维持了已实现的体重减轻,提示肥胖患者达到一定的体重减轻后,可减少给药次数以维持效果。
口服制剂具有更好的便利性,有利于提高治疗依从性,实现更佳的治疗效果。HRS9531片作为国内首个在国际舞台公布数据的口服GLP-1/GIP多肽制剂,其临床价值也在积极探索中。此次ADA年会上公布的Ⅰ期研究显示,HRS9531片在健康受试者中具有良好的安全性和耐受性,药代动力学特性与注射制剂一致,且MAD结果也显示,HRS9531片具有明确的减重和降糖作用。
综上所述,HRS9531的临床研究结果为其在超重或肥胖症治疗中的应用提供了有力支持,HRS9531片剂的开发有望为患者提供更为便捷的治疗选择,提高治疗依从性。随着更多临床数据的积累,HRS9531或将成为T2DM和肥胖症治疗领域的重要药物之一,为患者带来更多的治疗选择和希望。
参考文献
1. Efficacy and Safety of HRS9531, a Novel Dual GLP-1/GIP Receptor Agonist, in Chinese Overweight or Obese Adults Without Diabetes
2. Efficacy and Safety of a Novel Dual GLP-1/GIP Receptor Agonist (HRS9531), in Obese Adults Without Diabetes: Up to 52-week treatment
3. Safety, Tolerability, Pharmacokinetics, and Pharmacodynamics of HRS9531 Tablet, an Oral Dual GLP-1/GIP Receptor Agonist, in Healthy Participants: A Phase 1 Study
4. Zhao L, et al. 1861-LB Efficacy and Safety of HRS9531, a Novel Dual GLP-1/GIP Receptor Agonist, in Obese Adults: A Phase 2 Trial. Presented at ADA 2024.
5. Zhao J, et al. LBA-66 Efficacy and safety of HRS9531, a novel dual GLP-1/GIP receptor agonist, in patients with type 2 diabetes mellitus (T2DM): a phase 2 trial. Presented at EASD annual meeting.











 京公网安备 11010502033361号
京公网安备 11010502033361号
发布留言