酮体的代谢调控
酮体(KBs)包括乙酰乙酸(20%)、β-羟丁酸(β-OHB,78%)和丙酮(2%),在葡萄糖缺乏时酮体可以代替葡萄糖为机体供能。肝线粒体内生成的酮体是循环中酮体的主要来源,其限速酶是HMGCS2。酮体的代谢主要在肝外线粒体和细胞质中完成,分别用于氧化供能和合成脂肪、胆固醇。成人隔夜空腹状态下,血酮体浓度约为0.1~0.4 mM,禁食2天后达到1~2 mM,禁食约5天后达到新稳态,此时酮体浓度为7~10 mM,酮症酸中毒时约为15 mM。
HMGCS2是酮体生成的限速酶,其转录受Foxa2的影响,Foxa2活性受胰岛素、胰高糖素分泌的调节。进食后,胰岛素信号通过Thr156磷酸化,导致Foxa2失活,抑制Foxa2靶基因表达,抑制肝脏脂质代谢和糖异生。禁食后,血浆胰岛素水平下降,胰高血糖素水平上升,激活腺苷酸环化酶,导致抑制p300活性的负调节因子SIK2受抑制,p300对Foxa2 Lys259的乙酰化增加,促进Foxa2靶基因表达,肝脏脂质代谢和糖异生增强。胰高血糖素还可激活脂肪酶,促进脂肪分解,加强脂肪酸氧化,使酮体生成增多。
另外,酮体的肾小管重吸收也是血酮体水平的重要调控因素。酮体回吸收依赖于近端肾小管腔侧的SMCT1及SMCT2。其中SMCT1在近端肾小管S3段高表达,高亲和力转运酮体。酮体在肾小球自由滤出后,80%以上可被近曲小管重吸收,仅有<1%的酮体被分泌到尿液中。饥饿状态时,肾脏重吸收酮体增加,以满足肾脏的能量需求[1]。
生理性酮体对肾脏代谢的影响
研究表明[2],丙酮增加离体肾脏糖异生和氧耗量;动物研究证实,饥饿时乙酰乙酸可为大鼠肾脏提供能量[2],乙酰乙酸易被大鼠肾脏吸收,且乙酰乙酸浓度越高,对氧化供能的占比越高,5.0 mM时供能66.8%,大鼠禁食48h后,低浓度乙酰乙酸为大鼠供能的效应减弱,但较高浓度乙酰乙酸仍持续为大鼠供能,5.0 mM时供能47%。β-OHB通过抑制氧化应激[3]、减轻高血糖引起的足细胞衰老和损伤[4],发挥肾脏保护作用。另外,动物研究发现[5],β-OHB治疗显著减轻肾脏肥大,改善蛋白尿,改善肾小球细胞外基质积聚及肾小球基底膜增厚。生酮治疗对DKD的保护作用
生酮饮食(KD)是一种以高脂肪、低碳水化合物为主,辅以适量蛋白质和其他营养素的饮食方案。KD中碳水化合物的供给量占供能比<10%。作为一种饮食治疗方法,KD在DKD的治疗也进行了相关研究。一项研究[6]评估了极低碳水化合物生酮饮食(VLCKD)治疗肥胖和轻度肾功能衰竭患者的有效性和安全性。研究共纳入38例CKD2期(eGFR 60~89 ml/min),54例肾功能正常者(eGFR≥90 ml/min),给予碳水化合物20~50 g/day、蛋白质1~1.4 g/kg、脂质15~30 g/day;观察3个月,研究结束时,平均减重幅度接近初始体重的20%,脂肪量显著减少,27.7%的轻度肾功能不全患者在KD干预后肾功能恢复正常。该研究结果表明,在医疗专业人员的监督下进行VLCKD对肥胖患者(包括轻度肾损伤患者)而言是一种有效和安全的减重方法。动物研究结果表明[7],KD改善缺血诱导的急性肾损伤,降低血尿素氮(BUN)和肌酐,缓解缺血诱导的热休克蛋白70的增加。此外,KD还可通过改善氧化应激和炎症反应,对肾脏纤维化等慢性肾损伤也有明显改善作用。DKD患者肾脏能量代谢重编程,脂肪分解代谢受抑制,酮体氧化供能增加,补充酮体可通过阻断mTORC1信号改善肾损伤。SGLT2抑制剂可使血液及肾脏酮体水平增加,通过促进酮体诱导的mTORC1抑制,发挥对DKD的保护作用。
2型糖尿病患者体内β-羟丁酸浓度与DKD风险呈J型关联
常宝成、杨菊红教授团队进行了一项研究[8],探讨2型糖尿病(T2DM)患者循环β-OHB与DKD风险的关系。共纳入1388例T2DM患者。将研究对象分为高β-OHB组(0.31~1.00mM)和正常β-OHB组(0.02~0.30mM),正常β-OHB组根据β-OHB四分位数(Q)分为4个亚组。结果表明,高β-OHB组患者年龄更小(P=0.003),糖尿病病程更短(P=0.001),HbA1c更高(P<0.001),舒张压(DBP)高于正常β-OHB组(P=0.018)。高β-OHB组的DKD患病率高于正常β-OHB组(43.3% vs. 33.3%,P=0.041)。Q4组(β-OHB:0.12~0.30 mM)的DKD患病率最低(P=0.001)。回归分析显示,在校正其他危险因素后,相对于Q4亚组,前3亚组DKD风险更高[OR(95%CI),Q1:2.30(1.62~3.26),Q2:1.80(1.23~2.62),Q3:1.63(1.10~2.41)]。
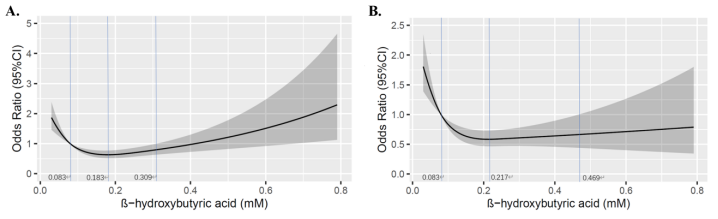
多变量校正限制性立方样条(RCS)显示,β-OHB与DKD风险呈J型相关(图1),β-OHB在0.083~0.309 mM时DKD风险更低(图1A),β-OHB在0.183 mM时风险最低(OR=0.63,95%CI:0.52~0.77)。β-OHB在0.083~0.469 mM范围内,白蛋白尿(ADKD)风险降低(图1B),提示β-OHB可能对蛋白尿有更好的保护作用。上述结果提示,T2DM患者血酮体水平与DKD风险呈J型关联,血β-OHB在0.12~0.30 mM范围内,DKD患病风险较低。
酮体代谢在肾保护中的作用还存在争议
关于酮体在肾保护中的作用尚存在矛盾之处(主要是体外实验结果)。长期以来,酮体一直被认为是糖尿病中不受欢迎的代谢物,因为它们与危及糖尿病患者生命的酮症酸中毒有关。酮症酸中毒作为糖尿病的急性并发症,可引起急性肾损伤。另外,体外实验发现,β-OHB水平升高可增加肾小管上皮细胞内TGF-β1含量,胶原蛋白I、IV表达增加,促进EMT发生[10]。高浓度β-OHB干预肾小管细胞,激活TGF-β/smad3通路,导致细胞增殖能力下降,细胞内胶原含量增加[11]。结语
酮体在DKD防治中的作用值得关注,酮体对肾脏的保护作用可能与其浓度有关,适度提高酮体水平可能对肾脏有保护作用。
专家简介

常宝成 教授
医学博士,主任医师
博士生导师
主要社会兼职:
中国医师协会内分泌代谢科医师分会 常委
天津中西医结合学会内分泌专业委员会 主任委员
天津糖尿病学会 副主任委员
留学日本京都大学。主持包括国家自然科学基金、天津市慢病重大专项等课题11项。国内外期刊发表论著200余篇,主编参编著作等11部。2次荣获天津市科技进步二等奖,获天津市优秀科技工作者、津门医学英才、天津名医等称号。
参考文献
1.Review3.314 Diabetes Metab Res Rev. 2017 Jul;33(5).
2.Weidemann MJ, Krebs HA. Biochem J. 1969;112(2):149-166. doi:10.1042/bj1120149
3.Shimazu T, Hirschey MD, et al. Science. 2013;339(6116):211-214.
4.Fang Y, Chen B, et al. Kidney Int. 2021;100(5):1037-1053.
5.Kidney Int. 2021 November ; 100(5): 1037-1053.
6.Bruci A, Tuccinardi D, et al. Nutrients. 2020;12(2):333.
7.Life Sci. 2022 Jan 15;289:12022.
8.Ying L,Jingyu W, Baocheng Ch, et al. Diabetes Obes Metab. 2023; 1-10.
9.Guo Z, Juhong Y, Baocheng Ch,et al. Nephrol Dial Transplant. 2023;gfad173.
10.Zhang D.Am J Physiol Endocrinol Metab. 2011 Feb;300(2):E287-95.
11.Guh JY. Kidney Int. 2003 Dec;64(6):2041-51.










 京公网安备 11010502033361号
京公网安备 11010502033361号
发布留言