导语
全球老龄化形势严峻,老年痴呆症高发。第85届美国糖尿病协会科学年会(ADA 2025)一场题为“老龄化与健康老龄——糖尿病、认知功能与老年人群”的口头报告专题中,4位研究者揭示了糖尿病与脑健康(特别是认知功能下降和痴呆风险)之间复杂关联的新进展。这些关键发现为优化糖尿病管理以促进脑健康、阻击老年痴呆、实现健康老龄化提供了更多证据。
21-OR
SGLT2i与GLP-1RA对2型糖尿病患者痴呆风险影响的系统综述与荟萃分析
Systematic Review and Meta-analysis of the Association of SGLT2 Inhibitors and GLP-1 Receptor Agonists on the Risk of Dementia in Patients with Type 2 Diabetes
引言与目的
观察性研究关于钠-葡萄糖共转运蛋白2抑制剂(SGLT2i)和胰高糖素样肽-1受体激动剂(GLP-1RA)对2型糖尿病(T2DM)患者痴呆风险影响的结果存在矛盾。本研究旨在通过荟萃分析评估这两类药物与痴呆风险之间的关联。
方法
系统检索截至2024年10月的PubMed、EMBASE和CENTRAL数据库,筛选出评估SGLT2i或GLP-1RA与T2DM患者痴呆风险[包括全因痴呆、阿尔茨海默病(AD)和血管性痴呆(VD)]关联的研究。采用ROBINS-I工具评估纳入研究的偏倚风险。使用基于逆方差加权的随机效应模型进行荟萃分析,计算痴呆风险的合并风险比(HR)及其95%置信区间(CI)。对年龄>60岁的老年患者、包含1年滞后期的研究以及使用活性对照药物[如二肽基肽酶-4抑制剂(DPP-4i)]的研究进行亚组分析。
结果
共纳入18项观察性研究,涉及3 008 234例患者。与不使用相比,SGLT2i的使用与全因痴呆(HR 0.76,95%CI:0.67~0.85)、AD(HR 0.75,95%CI:0.61~0.92)以及VD(HR 0.58,95%CI:0.44~0.78)的风险降低相关。同样,与不使用相比,GLP-1RA的使用也与全因痴呆(HR 0.77,95%CI:0.67~0.89)以及AD(HR 0.42,95%CI:0.34~0.50)的风险降低相关。在老年患者亚组中、在采用1年滞后期分析的研究中,以及以DPP-4i为活性对照的研究中,均观察到SGLT2i或GLP-1RA治疗与较低的全因痴呆风险相关。
结论
本荟萃分析表明,使用SGLT2i或GLP-1RA与T2DM患者痴呆风险显著降低相关。然而,鉴于观察性研究中存在的显著异质性,未来需要通过大规模随机对照试验来进一步验证这些发现。
22-OR
美国2型糖尿病亚型与痴呆风险
Type 2 Diabetes Subtypes and Risk of Dementia in the United States
引言与目的
痴呆症正日益被视为T2DM的一种新兴并发症,其发生可能与慢性高血糖和胰岛素抵抗有关。本研究旨在评估具有不同临床特征及血管并发症风险的T2DM亚型之间的痴呆症风险差异。
方法
从Epic Cosmos平台识别2012~2023年新诊断的T2DM患者(n=727 076;平均年龄64.4±13.3岁;女性占52%),并将其分为4个亚型:严重胰岛素缺乏型糖尿病(SIDD,21.6%)、轻度肥胖相关型糖尿病(MOD,23.8%)、轻度年龄相关型糖尿病(MARD,40.9%)以及未分类糖尿病(即混合型,13.7%)。使用ICD-10-CM编码识别T2DM诊断后10年内首次发生的任何痴呆症,以及血管性痴呆、阿尔茨海默病和其他痴呆症的特定风险。采用Cox比例风险模型计算各亚型经协变量调整后的痴呆症风险绝对和相对风险比(HR)。
结果
分析结果显示,与MOD亚型相比,SIDD(HR 2.25,95%CI:1.92~2.64)和MARD(HR 2.00,95%CI:1.70~2.34)亚型发生任何痴呆症的风险显著更高(图1),未分类糖尿病的痴呆症风险介于两者之间(HR 1.38,95%CI:1.16~1.65)。同样,相较于MOD和未分类糖尿病,SIDD和MARD亚型发生血管性痴呆、阿尔茨海默病及其他类型痴呆症的风险也更高。
结论
T2DM不同亚型患者的痴呆症风险存在差异,这凸显了针对SIDD和MARD亚型制定针对性预防策略并开展早期筛查研究的必要性。
23-OR
强化生活方式干预对患有糖尿病和超重/肥胖的老年人群20年全因死亡率的益处——Look AHEAD研究
Benefit of an Intensive Lifestyle Intervention on All-Cause Mortality over Two Decades in Older Adults with Diabetes and Overweight/Obesity—The Look AHEAD Study
引言与目的
Look AHEAD是一项于2001年启动的随机对照试验,在5145例超重或肥胖的T2DM患者中,比较了强化生活方式干预(ILI)与糖尿病支持与教育(DSE)的长期效果。在为期10年的干预期内及后续长达17年的随访期间,两组间的全因死亡率均未观察到显著差异。自试验于2012年结束以来,该队列在一项观察性研究中持续接受随访。在此期间,ILI组相较于DSE组始终维持着显著更大的累积体重减轻。鉴于ILI的潜在获益可能需要更长时间方能显现,研究人员开展了密集的死亡事件追踪,新增确认了500例死亡病例。基于此,本研究采用意向性治疗分析方法,旨在比较ILI组与DSE组在长达23年随访期内的全因死亡率。
方法
该队列最初纳入5145例年龄45~76岁的成人T2DM患者,其中59%为女性,37%来自代表性不足的群体,14%有心血管疾病史。本次分析的主要结局指标是从随机分组直至23年随访期结束的全因死亡率。其他结局包括与预设亚组的交互作用分析。分析采用比例风险回归和似然比检验。
结果
在总计80 725人年随访期间,共记录到1661例死亡(ILI组800例,DSE组861例)。与DSE组相比,ILI组的全因死亡率风险降低(HR 0.89,95%CI:0.81~0.98)。预设的年龄、性别和心血管病史亚组均未显示与治疗组存在显著的交互作用。然而,种族/族裔与治疗组之间存在交互作用(P=0.01),具体而言,在自报为西班牙裔/拉丁裔的参与者中,ILI 显示出显著的生存获益(HR 0.54,95%CI:0.39~0.74),而在白种人(HR 0.94,95%CI:0.84~1.05)和非裔美国人(HR 0.96,95%CI:0.75~1.23)亚组中,风险降低未达到统计学显著性。
结论
以减重为核心的ILI轻微降低了超重或肥胖T2DM患者的长期死亡风险,这一效应似乎主要由西班牙裔/拉丁裔参与者死亡率的显著降低所驱动。
24-OR
糖尿病周围神经病变作为脑部疾病的风险因素
Diabetic Peripheral Neuropathy as a Risk Factor for Brain Disease
引言与目的
糖尿病周围神经病变(DPN)可能增加认知障碍和痴呆的风险。本研究旨在探讨DPN作为脑部疾病[定义为脑血管疾病(CBVD)和全因痴呆]危险因素的作用。
方法
这项基于登记的队列研究整合了哥本哈根斯泰诺糖尿病中心(一家糖尿病门诊诊所)和丹麦国家健康登记处的数据。研究对象为1998~2020年无脑部疾病史且可获得振动感觉阈值(VPT)测量值的个体。神经病变定义为:VPT>25 V(表示保护性感觉丧失)或VPT>年龄-性别-身高调整阈值(表示早期神经病变)。痴呆和CBVD通过ICD-10诊断代码和相关操作代码识别。使用泊松回归模型比较有神经病变者与无神经病变者结局事件的发病率比(IRR)。模型校正年龄、性别、日历年份、糖尿病病程、教育水平、体重指数(BMI)、血压、血脂、糖化血红蛋白(HbA1c)、吸烟、饮酒以及心血管疾病等协变量。在痴呆分析中,额外校正了抑郁症因素。IRR分析分别针对1型糖尿病(T1DM)和T2DM患者进行,并对上述两种神经病变定义分别评估。在一个亚组人群中,进一步校正了肾病和视网膜病变因素。
结果
研究共纳入5641例T1DM患者(平均年龄40.5±15.8岁,45.3%为女性)和9395例T2DM患者(平均年龄59.9±13.0岁,38.6%为女性)。采用25 V阈值定义神经病变时,与无神经病变者相比,有神经病变的T1DM患者痴呆的IRR为1.57(95%CI:0.73~3.37),T2DM患者为4.30(95%CI:2.05~9.04);CBVD的IRR在T1DM患者中为1.50(95%CI:1.30~1.97),在T2DM患者中为1.48(95%CI:1.20~1.83)。值得注意的是,额外校正视网膜病变和肾病因素后,仅在T1DM患者的CBVD分析中观察到IRR显著变化,整体IRR降至1.18(95%CI:0.87~1.60)。采用早期神经病变定义进行分析时,结果相似。
结论
全球老龄化形势严峻,老年痴呆症高发。第85届美国糖尿病协会科学年会(ADA 2025)一场题为“老龄化与健康老龄——糖尿病、认知功能与老年人群”的口头报告专题中,4位研究者揭示了糖尿病与脑健康(特别是认知功能下降和痴呆风险)之间复杂关联的新进展。这些关键发现为优化糖尿病管理以促进脑健康、阻击老年痴呆、实现健康老龄化提供了更多证据。
21-OR
SGLT2i与GLP-1RA对2型糖尿病患者痴呆风险影响的系统综述与荟萃分析
Systematic Review and Meta-analysis of the Association of SGLT2 Inhibitors and GLP-1 Receptor Agonists on the Risk of Dementia in Patients with Type 2 Diabetes
引言与目的
观察性研究关于钠-葡萄糖共转运蛋白2抑制剂(SGLT2i)和胰高糖素样肽-1受体激动剂(GLP-1RA)对2型糖尿病(T2DM)患者痴呆风险影响的结果存在矛盾。本研究旨在通过荟萃分析评估这两类药物与痴呆风险之间的关联。
方法
系统检索截至2024年10月的PubMed、EMBASE和CENTRAL数据库,筛选出评估SGLT2i或GLP-1RA与T2DM患者痴呆风险[包括全因痴呆、阿尔茨海默病(AD)和血管性痴呆(VD)]关联的研究。采用ROBINS-I工具评估纳入研究的偏倚风险。使用基于逆方差加权的随机效应模型进行荟萃分析,计算痴呆风险的合并风险比(HR)及其95%置信区间(CI)。对年龄>60岁的老年患者、包含1年滞后期的研究以及使用活性对照药物[如二肽基肽酶-4抑制剂(DPP-4i)]的研究进行亚组分析。
结果
共纳入18项观察性研究,涉及3 008 234例患者。与不使用相比,SGLT2i的使用与全因痴呆(HR 0.76,95%CI:0.67~0.85)、AD(HR 0.75,95%CI:0.61~0.92)以及VD(HR 0.58,95%CI:0.44~0.78)的风险降低相关。同样,与不使用相比,GLP-1RA的使用也与全因痴呆(HR 0.77,95%CI:0.67~0.89)以及AD(HR 0.42,95%CI:0.34~0.50)的风险降低相关。在老年患者亚组中、在采用1年滞后期分析的研究中,以及以DPP-4i为活性对照的研究中,均观察到SGLT2i或GLP-1RA治疗与较低的全因痴呆风险相关。
结论
本荟萃分析表明,使用SGLT2i或GLP-1RA与T2DM患者痴呆风险显著降低相关。然而,鉴于观察性研究中存在的显著异质性,未来需要通过大规模随机对照试验来进一步验证这些发现。
22-OR
美国2型糖尿病亚型与痴呆风险
Type 2 Diabetes Subtypes and Risk of Dementia in the United States
引言与目的
痴呆症正日益被视为T2DM的一种新兴并发症,其发生可能与慢性高血糖和胰岛素抵抗有关。本研究旨在评估具有不同临床特征及血管并发症风险的T2DM亚型之间的痴呆症风险差异。
方法
从Epic Cosmos平台识别2012~2023年新诊断的T2DM患者(n=727 076;平均年龄64.4±13.3岁;女性占52%),并将其分为4个亚型:严重胰岛素缺乏型糖尿病(SIDD,21.6%)、轻度肥胖相关型糖尿病(MOD,23.8%)、轻度年龄相关型糖尿病(MARD,40.9%)以及未分类糖尿病(即混合型,13.7%)。使用ICD-10-CM编码识别T2DM诊断后10年内首次发生的任何痴呆症,以及血管性痴呆、阿尔茨海默病和其他痴呆症的特定风险。采用Cox比例风险模型计算各亚型经协变量调整后的痴呆症风险绝对和相对风险比(HR)。
结果
分析结果显示,与MOD亚型相比,SIDD(HR 2.25,95%CI:1.92~2.64)和MARD(HR 2.00,95%CI:1.70~2.34)亚型发生任何痴呆症的风险显著更高(图1),未分类糖尿病的痴呆症风险介于两者之间(HR 1.38,95%CI:1.16~1.65)。同样,相较于MOD和未分类糖尿病,SIDD和MARD亚型发生血管性痴呆、阿尔茨海默病及其他类型痴呆症的风险也更高。
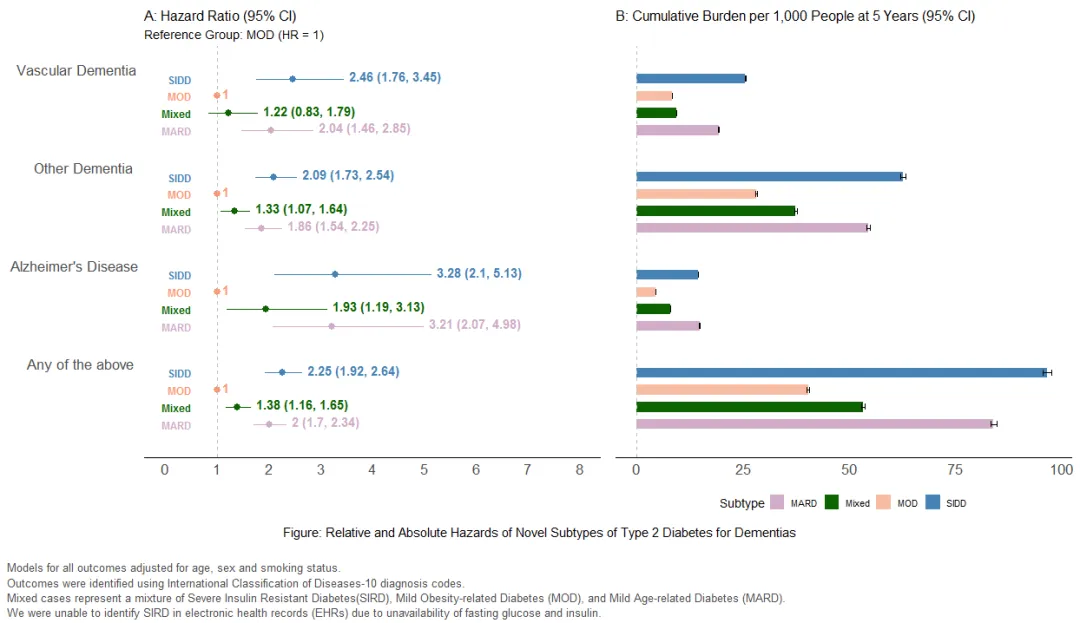
图1. T2DM患者不同痴呆亚型的相对和绝对风险
T2DM不同亚型患者的痴呆症风险存在差异,这凸显了针对SIDD和MARD亚型制定针对性预防策略并开展早期筛查研究的必要性。
23-OR
强化生活方式干预对患有糖尿病和超重/肥胖的老年人群20年全因死亡率的益处——Look AHEAD研究
Benefit of an Intensive Lifestyle Intervention on All-Cause Mortality over Two Decades in Older Adults with Diabetes and Overweight/Obesity—The Look AHEAD Study
引言与目的
Look AHEAD是一项于2001年启动的随机对照试验,在5145例超重或肥胖的T2DM患者中,比较了强化生活方式干预(ILI)与糖尿病支持与教育(DSE)的长期效果。在为期10年的干预期内及后续长达17年的随访期间,两组间的全因死亡率均未观察到显著差异。自试验于2012年结束以来,该队列在一项观察性研究中持续接受随访。在此期间,ILI组相较于DSE组始终维持着显著更大的累积体重减轻。鉴于ILI的潜在获益可能需要更长时间方能显现,研究人员开展了密集的死亡事件追踪,新增确认了500例死亡病例。基于此,本研究采用意向性治疗分析方法,旨在比较ILI组与DSE组在长达23年随访期内的全因死亡率。
方法
该队列最初纳入5145例年龄45~76岁的成人T2DM患者,其中59%为女性,37%来自代表性不足的群体,14%有心血管疾病史。本次分析的主要结局指标是从随机分组直至23年随访期结束的全因死亡率。其他结局包括与预设亚组的交互作用分析。分析采用比例风险回归和似然比检验。
结果
在总计80 725人年随访期间,共记录到1661例死亡(ILI组800例,DSE组861例)。与DSE组相比,ILI组的全因死亡率风险降低(HR 0.89,95%CI:0.81~0.98)。预设的年龄、性别和心血管病史亚组均未显示与治疗组存在显著的交互作用。然而,种族/族裔与治疗组之间存在交互作用(P=0.01),具体而言,在自报为西班牙裔/拉丁裔的参与者中,ILI 显示出显著的生存获益(HR 0.54,95%CI:0.39~0.74),而在白种人(HR 0.94,95%CI:0.84~1.05)和非裔美国人(HR 0.96,95%CI:0.75~1.23)亚组中,风险降低未达到统计学显著性。
结论
以减重为核心的ILI轻微降低了超重或肥胖T2DM患者的长期死亡风险,这一效应似乎主要由西班牙裔/拉丁裔参与者死亡率的显著降低所驱动。
24-OR
糖尿病周围神经病变作为脑部疾病的风险因素
Diabetic Peripheral Neuropathy as a Risk Factor for Brain Disease
引言与目的
糖尿病周围神经病变(DPN)可能增加认知障碍和痴呆的风险。本研究旨在探讨DPN作为脑部疾病[定义为脑血管疾病(CBVD)和全因痴呆]危险因素的作用。
方法
这项基于登记的队列研究整合了哥本哈根斯泰诺糖尿病中心(一家糖尿病门诊诊所)和丹麦国家健康登记处的数据。研究对象为1998~2020年无脑部疾病史且可获得振动感觉阈值(VPT)测量值的个体。神经病变定义为:VPT>25 V(表示保护性感觉丧失)或VPT>年龄-性别-身高调整阈值(表示早期神经病变)。痴呆和CBVD通过ICD-10诊断代码和相关操作代码识别。使用泊松回归模型比较有神经病变者与无神经病变者结局事件的发病率比(IRR)。模型校正年龄、性别、日历年份、糖尿病病程、教育水平、体重指数(BMI)、血压、血脂、糖化血红蛋白(HbA1c)、吸烟、饮酒以及心血管疾病等协变量。在痴呆分析中,额外校正了抑郁症因素。IRR分析分别针对1型糖尿病(T1DM)和T2DM患者进行,并对上述两种神经病变定义分别评估。在一个亚组人群中,进一步校正了肾病和视网膜病变因素。
结果
研究共纳入5641例T1DM患者(平均年龄40.5±15.8岁,45.3%为女性)和9395例T2DM患者(平均年龄59.9±13.0岁,38.6%为女性)。采用25 V阈值定义神经病变时,与无神经病变者相比,有神经病变的T1DM患者痴呆的IRR为1.57(95%CI:0.73~3.37),T2DM患者为4.30(95%CI:2.05~9.04);CBVD的IRR在T1DM患者中为1.50(95%CI:1.30~1.97),在T2DM患者中为1.48(95%CI:1.20~1.83)。值得注意的是,额外校正视网膜病变和肾病因素后,仅在T1DM患者的CBVD分析中观察到IRR显著变化,整体IRR降至1.18(95%CI:0.87~1.60)。采用早期神经病变定义进行分析时,结果相似。
结论
DPN是T2DM患者发生痴呆和脑血管疾病的独立危险因素。这一发现表明DPN是早期预防策略的重要靶点。













 京公网安备 11010502033361号
京公网安备 11010502033361号
发布留言