导语
在第85届美国糖尿病协会科学年会(ADA2025)上,Banting科学成就奖的颁发无疑是最激动人心的时刻之一。该奖项是ADA的最高科学荣誉,旨在纪念在胰岛素发现中扮演关键角色的医学科学家、医生及诺贝尔奖获得者Frederick Banting。本届奖项授予华盛顿大学糖尿病研究中心主任Steven Kahn博士,以表彰其在探索β细胞在糖尿病前期及2型糖尿病(T2DM)发病机制与治疗中的核心作用所做出的杰出贡献。
当地时间6月22日上午举行的“医学与科学主席演讲和Banting科学成就奖”专题环节中,ADA医学与科学主席Rita Rastogi Kalyani博士首先发表题为“把进步变成希望——糖尿病未竟之旅”的主题演讲。随后,Steven Kahn博士发表了其获奖讲座,题为“重新审视β细胞——解开T2DM谜题关键”。一起来领略大咖的学术成就!
主席演讲:把进步变成希望——糖尿病未竟之旅

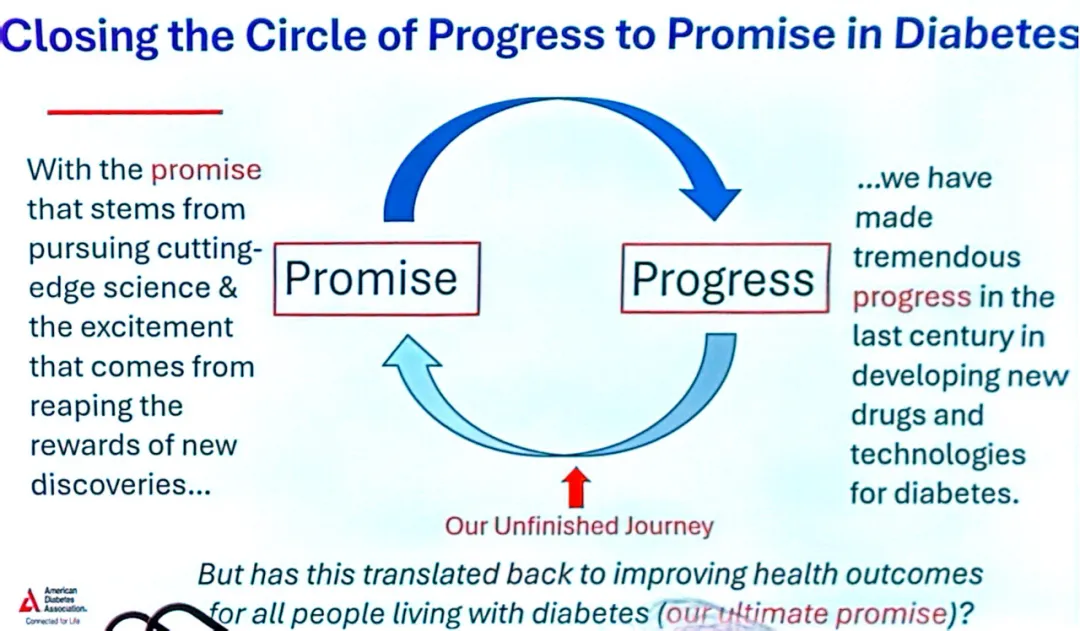
ADA医学与科学主席Rita Rastogi Kalyani博士指出,胰岛素问世已逾百年,ADA本身也迎来了成立85周年。如今可用的糖尿病药物类别和具体药物种类比以往任何时候都丰富,关于通过饮食、药物和手术治疗实现糖尿病缓解的讨论也日趋深入。然而,糖尿病领域尚未实现其终极目标——改善每一位糖尿病患者的健康结局。Kalyani博士表示,“在这个领域,我们已跨越许多障碍,但前方仍存在一些尤为艰巨的挑战。从进展到承诺的闭环是我们未完成的旅程。”
她回顾道,ADA的历程始于1939年于新奥尔良举行的美国内科医师学会会议上,当时6位医生对缺乏专门讨论糖尿病的团体感到困惑。1940年举行的首届ADA会议,仅吸引了26位参会者。如今,该组织已发展成为糖尿病研究和管理领域的全球领导者,见证了新型药物的开发——这些药物能够预防动脉粥样硬化性心血管疾病(ASCVD)、心力衰竭和慢性肾脏病(CKD),并带来显著的体重减轻。同时,新型胰岛素和新技术减轻了糖尿病日常管理的负担,免疫疗法现已能延缓1型糖尿病(T1DM)的发生,胰岛移植已成为临床现实。
Kalyani博士继而提出关键问题:“那么,为何我们仍未达到糖尿病领域的终极目标呢?”她分析认为,原因之一是临床惰性。一项针对糖尿病合并ASCVD患者的大型医疗系统研究发现,截至2021年,内分泌科医师对钠-葡萄糖协同转运蛋白2抑制剂(SGLT2i)和胰高糖素样肽-1受体激动剂(GLP-1RA)的处方率仅为22%,初级保健提供者和心脏病专家的处方率则分别低至13%和1.8%。
此外,全球糖尿病患病率持续攀升。国际糖尿病联盟(IDF)发布的2025糖尿病地图显示,全球成年人口的糖尿病负担已达11%,即5.89亿人,且仍在增长。青少年发病糖尿病的并发症发生率也在增加。TODAY研究(研究对象基线年龄在10~17岁)报告称,在超过15年随访期间,包括神经、视网膜或肾脏疾病在内的微血管并发症发生率高达80.1%。
同样令人担忧的是,20~44岁成人的糖化血红蛋白(HbA1c)控制率正在恶化。Kalyani博士强调:“我们最年轻的成人群体,他们在一生中累积并发症的风险最大,恰恰是HbA1c水平最不理想的人群。”她进一步指出,种族和民族因素也显著影响HbA1c达标率,在参保人群中,西班牙裔、非西班牙裔黑人和非西班牙裔白人的未达标比例更高。
在美国,超过80%的确诊糖尿病患者由初级保健管理,因为该国大部分地区缺乏当地的内分泌专科诊疗资源。Kalyani博士总结道:“我们已经取得长足进步,但仍然任重道远。在我们当前拥有的知识与未来为满足所有糖尿病患者需求所需采取的行动之间,存在一道鸿沟。”
她继而指出,在国立卫生研究院(NIH)及其他公共科研机构能否持续存在尚不确定的环境下,很难预测这道鸿沟将以何种方式、在何时得以弥合。她引用了作家Peter Drucker的话补充道,预测未来最好的方式就是创造未来。Kalyani博士宣告:“我们就是承诺,行动的时刻就是现在。我们今日共同完成的工作从未如此关键。”她呼吁同仁积极参与ADA,投身专业教育和科学会议,并鼓励他人加入;随时了解最新的临床指南以提供最高标准的管理;投资于指导下一代以推动创新研究;并教育专业群体和公众群体。她强调:“而最重要的是,用你的声音,大声疾呼!NIH、美国疾病预防与控制中心(CDC)及其他政府机构无法为自己发声。”
Banting奖得主阐述β细胞如何掌握T2DM的关键

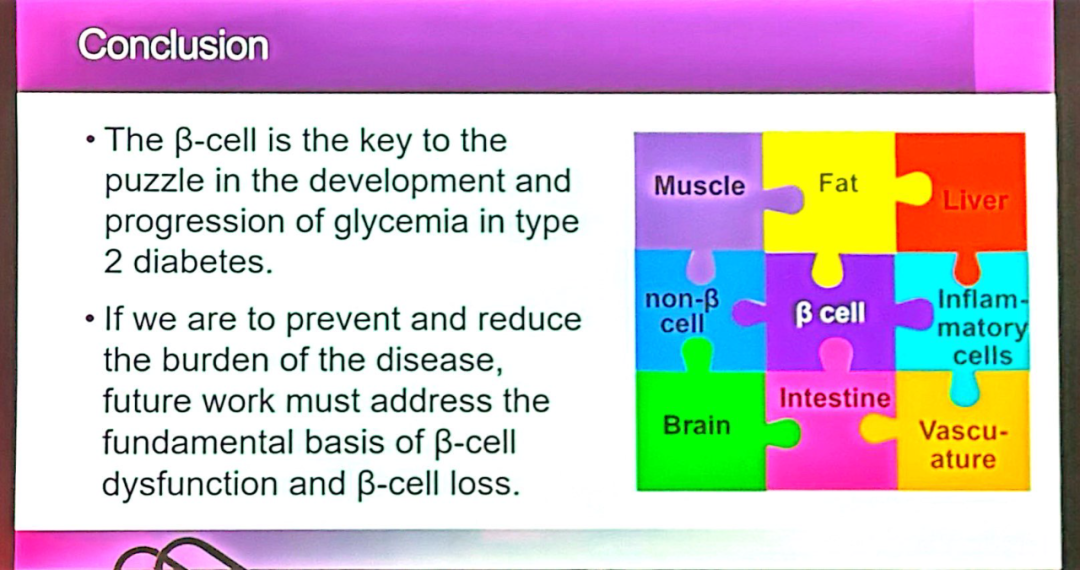
越来越多的证据表明,β细胞功能与数量的改变是T2DM发病机制和疾病进展的核心因素。临床前模型及早期临床研究均指出,胰岛内淀粉样蛋白沉积是导致β细胞功能障碍和死亡的机制之一,进而引发血糖控制进行性恶化。
Steven E. Kahn博士强调:“研究表明,胰岛淀粉样蛋白是T2DM中β细胞丢失的一种机制,而减少淀粉样蛋白形成可通过降低氧化应激和炎症来保护β细胞。因此,开发淀粉样蛋白抑制剂有望减缓T2DM进展。”
Kahn博士回顾道,T2DM的β细胞功能障碍早在1960年即有文献记载,而β细胞数量减少的现象则可追溯至1955年。长期以来,人们认识到胰岛素分泌细胞(β细胞)与胰岛素敏感组织(如肝脏、肌肉和脂肪)之间的反馈机制在调节胰岛素分泌和维持葡萄糖稳态中起着关键作用。Kahn博士的实验室在20世纪90年代明确了β细胞反应与胰岛素敏感性之间存在双曲线关系。较高的胰岛素敏感性与较高的β细胞反应相关。随着胰岛素敏感性下降,β细胞反应也随之减弱。而β细胞反应下降,导致空腹血糖水平升高。

T2DM治疗面临的一个现实挑战是,药物疗效随时间推移而下降。Kahn博士实验室的研究发现,不同类别的降糖药物、肠促胰素以及GLP-1RA的疗效均会逐渐减弱,这与进行性加重的β细胞功能障碍密切相关。他还指出,与成年人相比,年轻人的β细胞功能丧失速度更快,这解释了为何年轻患者的T2DM进展更为迅速。
Kahn博士解释,β细胞功能下降的一个重要原因是β细胞数量随时间持续减少。虽然多种因素可能导致β细胞丢失,但胰岛淀粉样蛋白沉积是一个主要机制。胰岛淀粉样多肽(IAPP)与胰岛素共同分泌,在T2DM中因未知原因会异常沉积形成纤维。这种淀粉样蛋白沉积与人类β细胞丢失显著相关,但在小鼠模型中则不然。为深入研究,Kahn博士实验室开发了携带人类胰岛细胞的转基因小鼠模型,并在该模型中观察到胰岛淀粉样蛋白沉积会诱发氧化应激,而阻断氧化应激则可减少淀粉样蛋白沉积和β细胞丢失。

在该小鼠模型中,胰岛淀粉样蛋白的形成还促进了巨噬细胞的浸润和积聚,并增强了炎症相关基因的表达。实验显示,添加生理浓度的促炎因子白细胞介素-1β(IL-1β)会进一步加剧淀粉样蛋白沉积和β细胞死亡。Kahn博士总结道:“我们相信存在一个恶性循环:淀粉样蛋白引发氧化应激,而氧化应激反过来又能促进淀粉样蛋白的产生。数据支持一个前馈机制——淀粉样蛋白形成引发炎症,炎症又通过IL-1β增加淀粉样蛋白沉积。”
在第85届美国糖尿病协会科学年会(ADA2025)上,Banting科学成就奖的颁发无疑是最激动人心的时刻之一。该奖项是ADA的最高科学荣誉,旨在纪念在胰岛素发现中扮演关键角色的医学科学家、医生及诺贝尔奖获得者Frederick Banting。本届奖项授予华盛顿大学糖尿病研究中心主任Steven Kahn博士,以表彰其在探索β细胞在糖尿病前期及2型糖尿病(T2DM)发病机制与治疗中的核心作用所做出的杰出贡献。
当地时间6月22日上午举行的“医学与科学主席演讲和Banting科学成就奖”专题环节中,ADA医学与科学主席Rita Rastogi Kalyani博士首先发表题为“把进步变成希望——糖尿病未竟之旅”的主题演讲。随后,Steven Kahn博士发表了其获奖讲座,题为“重新审视β细胞——解开T2DM谜题关键”。一起来领略大咖的学术成就!
主席演讲:把进步变成希望——糖尿病未竟之旅

ADA医学与科学主席Rita Rastogi Kalyani博士指出,胰岛素问世已逾百年,ADA本身也迎来了成立85周年。如今可用的糖尿病药物类别和具体药物种类比以往任何时候都丰富,关于通过饮食、药物和手术治疗实现糖尿病缓解的讨论也日趋深入。然而,糖尿病领域尚未实现其终极目标——改善每一位糖尿病患者的健康结局。Kalyani博士表示,“在这个领域,我们已跨越许多障碍,但前方仍存在一些尤为艰巨的挑战。从进展到承诺的闭环是我们未完成的旅程。”

她回顾道,ADA的历程始于1939年于新奥尔良举行的美国内科医师学会会议上,当时6位医生对缺乏专门讨论糖尿病的团体感到困惑。1940年举行的首届ADA会议,仅吸引了26位参会者。如今,该组织已发展成为糖尿病研究和管理领域的全球领导者,见证了新型药物的开发——这些药物能够预防动脉粥样硬化性心血管疾病(ASCVD)、心力衰竭和慢性肾脏病(CKD),并带来显著的体重减轻。同时,新型胰岛素和新技术减轻了糖尿病日常管理的负担,免疫疗法现已能延缓1型糖尿病(T1DM)的发生,胰岛移植已成为临床现实。
Kalyani博士继而提出关键问题:“那么,为何我们仍未达到糖尿病领域的终极目标呢?”她分析认为,原因之一是临床惰性。一项针对糖尿病合并ASCVD患者的大型医疗系统研究发现,截至2021年,内分泌科医师对钠-葡萄糖协同转运蛋白2抑制剂(SGLT2i)和胰高糖素样肽-1受体激动剂(GLP-1RA)的处方率仅为22%,初级保健提供者和心脏病专家的处方率则分别低至13%和1.8%。
此外,全球糖尿病患病率持续攀升。国际糖尿病联盟(IDF)发布的2025糖尿病地图显示,全球成年人口的糖尿病负担已达11%,即5.89亿人,且仍在增长。青少年发病糖尿病的并发症发生率也在增加。TODAY研究(研究对象基线年龄在10~17岁)报告称,在超过15年随访期间,包括神经、视网膜或肾脏疾病在内的微血管并发症发生率高达80.1%。
同样令人担忧的是,20~44岁成人的糖化血红蛋白(HbA1c)控制率正在恶化。Kalyani博士强调:“我们最年轻的成人群体,他们在一生中累积并发症的风险最大,恰恰是HbA1c水平最不理想的人群。”她进一步指出,种族和民族因素也显著影响HbA1c达标率,在参保人群中,西班牙裔、非西班牙裔黑人和非西班牙裔白人的未达标比例更高。
在美国,超过80%的确诊糖尿病患者由初级保健管理,因为该国大部分地区缺乏当地的内分泌专科诊疗资源。Kalyani博士总结道:“我们已经取得长足进步,但仍然任重道远。在我们当前拥有的知识与未来为满足所有糖尿病患者需求所需采取的行动之间,存在一道鸿沟。”
她继而指出,在国立卫生研究院(NIH)及其他公共科研机构能否持续存在尚不确定的环境下,很难预测这道鸿沟将以何种方式、在何时得以弥合。她引用了作家Peter Drucker的话补充道,预测未来最好的方式就是创造未来。Kalyani博士宣告:“我们就是承诺,行动的时刻就是现在。我们今日共同完成的工作从未如此关键。”她呼吁同仁积极参与ADA,投身专业教育和科学会议,并鼓励他人加入;随时了解最新的临床指南以提供最高标准的管理;投资于指导下一代以推动创新研究;并教育专业群体和公众群体。她强调:“而最重要的是,用你的声音,大声疾呼!NIH、美国疾病预防与控制中心(CDC)及其他政府机构无法为自己发声。”
Banting奖得主阐述β细胞如何掌握T2DM的关键

越来越多的证据表明,β细胞功能与数量的改变是T2DM发病机制和疾病进展的核心因素。临床前模型及早期临床研究均指出,胰岛内淀粉样蛋白沉积是导致β细胞功能障碍和死亡的机制之一,进而引发血糖控制进行性恶化。
Steven E. Kahn博士强调:“研究表明,胰岛淀粉样蛋白是T2DM中β细胞丢失的一种机制,而减少淀粉样蛋白形成可通过降低氧化应激和炎症来保护β细胞。因此,开发淀粉样蛋白抑制剂有望减缓T2DM进展。”
Kahn博士回顾道,T2DM的β细胞功能障碍早在1960年即有文献记载,而β细胞数量减少的现象则可追溯至1955年。长期以来,人们认识到胰岛素分泌细胞(β细胞)与胰岛素敏感组织(如肝脏、肌肉和脂肪)之间的反馈机制在调节胰岛素分泌和维持葡萄糖稳态中起着关键作用。Kahn博士的实验室在20世纪90年代明确了β细胞反应与胰岛素敏感性之间存在双曲线关系。较高的胰岛素敏感性与较高的β细胞反应相关。随着胰岛素敏感性下降,β细胞反应也随之减弱。而β细胞反应下降,导致空腹血糖水平升高。

T2DM治疗面临的一个现实挑战是,药物疗效随时间推移而下降。Kahn博士实验室的研究发现,不同类别的降糖药物、肠促胰素以及GLP-1RA的疗效均会逐渐减弱,这与进行性加重的β细胞功能障碍密切相关。他还指出,与成年人相比,年轻人的β细胞功能丧失速度更快,这解释了为何年轻患者的T2DM进展更为迅速。
Kahn博士解释,β细胞功能下降的一个重要原因是β细胞数量随时间持续减少。虽然多种因素可能导致β细胞丢失,但胰岛淀粉样蛋白沉积是一个主要机制。胰岛淀粉样多肽(IAPP)与胰岛素共同分泌,在T2DM中因未知原因会异常沉积形成纤维。这种淀粉样蛋白沉积与人类β细胞丢失显著相关,但在小鼠模型中则不然。为深入研究,Kahn博士实验室开发了携带人类胰岛细胞的转基因小鼠模型,并在该模型中观察到胰岛淀粉样蛋白沉积会诱发氧化应激,而阻断氧化应激则可减少淀粉样蛋白沉积和β细胞丢失。

在该小鼠模型中,胰岛淀粉样蛋白的形成还促进了巨噬细胞的浸润和积聚,并增强了炎症相关基因的表达。实验显示,添加生理浓度的促炎因子白细胞介素-1β(IL-1β)会进一步加剧淀粉样蛋白沉积和β细胞死亡。Kahn博士总结道:“我们相信存在一个恶性循环:淀粉样蛋白引发氧化应激,而氧化应激反过来又能促进淀粉样蛋白的产生。数据支持一个前馈机制——淀粉样蛋白形成引发炎症,炎症又通过IL-1β增加淀粉样蛋白沉积。”
人类细胞培养研究进一步证实,减少淀粉样蛋白形成有助于保护β细胞及其功能。Kahn博士指出,目前正在为阿尔茨海默病开发的淀粉样蛋白抑制剂,未来可能应用于T2DM的治疗。一项利用CT/PET氟贝他吡成像技术进行的人类概念验证研究已证实,T2DM患者胰腺中存在过量的淀粉样蛋白沉积。Kahn博士表示,若因国会议员和糖尿病界的巨大压力而暂停的国家糖尿病预防计划(DPP)长期随访研究(DPPOS,其联邦资助已于今年早些时候终止)能在今年夏末按计划重启,将计划开展验证性的影像学研究。










 京公网安备 11010502033361号
京公网安备 11010502033361号
发布留言